0 引 言
2018年《BP世界能源展望》指出,2040年我国依然是世界最大的煤炭市场,占全球煤炭需求的40%[1]。根据国家统计局数据显示,2018年我国全年能源消费总量46.4亿 t标准煤,煤炭消费量占能源消费总量的59.0%,用于发电的煤炭消费量占煤炭消费总量的40%以上[2]。在未来的很长时间内,煤炭在我国的能源利用结构中依然占据主导地位。
煤是由多种有机化合物和无机矿物质混合成的固体燃料,根据元素含量的不同,可以分为含量高于1 000 μg/g的主量元素(如C、H、O、N、S),含量在100~1 000 μg/g的次量元素(如K、Na、Fe、Si、Al、Ca、Mg、Ti、F、Cl、Br、I等)和含量低于100 μg/g的痕量元素(如As、Cd、Hg、Pb、Cu、Cr、Co、Ni等)[3]。煤炭的燃烧过程包括干燥、脱挥发分、燃烧、燃尽4个阶段,即随着温度升高,煤中水分蒸发,挥发分析出并燃烧,温度继续升高时余下的固定碳(焦炭)开始燃烧,放出大量的热。最后,未完全燃尽的焦炭继续燃烧,但由于灰分含量增多、氧浓度降低等因素,燃烧速度逐渐减慢。灰分部分留于灰渣,部分随烟气排入大气形成烟尘。电厂排放的颗粒物以亚微米颗粒物为主,主要由煤粉中的无机元素形成,形成途径主要包括内在矿物或外在矿物的熔融/聚合、破碎、气化/凝结等。煤炭中的主量元素在燃烧过程中产生CO2、NOx、SOx和挥发性有机化合物等,排放量大且浓度较高;痕量元素虽然含量低,排放总量不大,但是其毒性高,化学性质稳定,具有迁徙性、沉积性,对人体健康和生态环境影响极大[4]。烟气中的烟尘、SOx、NOx、重金属等成分是我国大气中各种污染物的主要排放源,其中约70%粉尘、90%SO2、67%NOx和43%Hg来源于火力发电厂[5]。燃煤电厂烟气主要含有72%~74%的N2、4.8%~26.9%的CO2、9.0%~13.8%的H2O和0.7%~15.0%的O2,同时也含有少量的NO(59~1 500 mg/(Nm3)、NO2(2~75 mg/(Nm3))、SO2(20~1 400 mg/(Nm3))、SO3(0~32 mg/(Nm3))、CxHy(0.008%~0.400%)、CO(100~11 250 mg/(Nm3))、颗粒物(2 000~15 000 mg/(Nm3))和重金属(2.2 mg/(Nm3))等[6]。其中,烟尘的特征主要取决于锅炉类型;SO2的生成量主要取决于燃煤成分;NOx以热力型和燃料型为主[7];重金属的排放浓度相对较低,但其种类多、形态复杂,主要分布于飞灰和烟气中[8-9]。燃煤电厂烟气对大气污染严重,减排刻不容缓。
我国环保部、国家发改委和国家能源局印发的《全面实施燃煤电厂超低排放和节能改造工作方案》[10]提到2020年,全国所有具备改造条件的燃煤电厂力争实现超低排放。即烟尘、SO2、NOx排放浓度(基准含氧量6%)分别不超过5、35、50 mg/m3。《中国制造2025》[11]、《煤炭工业发展“十三五”规划》[12]等重要文件均明确指出,亟需建设集约、安全、高效、绿色的现代煤炭工业体系,燃煤发电污染物排放要达到世界先进水平,电厂烟气减排任重道远。传统的电厂烟气处理技术包括烟尘控制、烟气脱硫和脱硝等。其中,烟尘控制技术分为机械式、过滤式、湿式和静电除尘[13],实现高效除尘时存在能耗大,产生废水等问题。烟气脱硫技术按过程的干湿状态可分为湿法、半干法和干法[13],其中湿式石灰/石灰石洗涤法具有技术成熟、价格低廉、副产物可回收利用等优点,但系统运行环境恶劣,易发生系统腐蚀和磨损。烟气脱硝技术分为吸收法、吸附法和还原法。吸收法主要有酸吸收法、碱吸收法、氧化吸收法等。吸附法常用吸附剂有分子筛、活性炭等,其吸收容量小,且需要间歇性操作进行吸附剂再生处理。选择性催化还原法(SCR)被广泛应用于电厂脱硝中,但需要定期更换催化剂,成本高,且还存在氨逃逸、反应器腐蚀、催化剂堵塞等问题。
传统燃煤电厂烟气减排技术中存在工艺设备复杂、能耗高、处理成本高及二次污染重等问题,而微藻烟气固碳减排技术具有经济环保等优势,受到了国内外研究者的广泛关注。通过微藻固碳减排技术处理烟气时,微藻细胞可以通过光合作用固定烟气中的CO2,及吸收NOx和SOx作为生长所需的氮源及硫源。Negoro等[14]将电厂烟气用于微藻培养,研究不同藻种在15%的CO2和不同浓度SOx、NOx条件下生长情况。Maeda等[15]筛选出的耐35 ℃高温、15%CO2的藻种Chlorella sp.T-l能够对电厂烟气中的氯、氟、粉尘等有足够抗性。Lee等[16]通过控制微藻培养基的pH,提高了Chlorella KR-1对SOx、NOx的耐受性。Westerhoff等[17]研究发现Scenedesmus sp.和Chlorella sp.可耐受20%的CO2,且光生物反应器的形式、大小及光程等影响微藻的生长速率。获得的微藻生物质可以通过能源转化技术得到生物柴油、乙醇、甲烷等高附加值产品[18]。微藻还能吸收烟气中的重金属离子(Hg、Se、As、Cd、Pb、Co、Cr等)。Napan等[19]研究燃煤烟气中不同浓度重金属(As、Cd、Co、Cr、Hg等)对微藻生长和脂质产量的影响。Cui等[20]进行室外电厂烟气对Spirulina maxima FACHB 438中蛋白质、叶绿素及重金属含量的影响实验,获得的微藻生物质质量符合中国食品/饲料添加剂标准。但燃煤电厂微藻烟气固碳减排技术的工业推广应用首先需要提高微藻的生物质产量,而实现微藻的高密度培养需要考虑藻种的选育、光照条件和营养元素等培养条件的优化、高效光生物反应器和曝气器结构形式的设计等多方面影响因素。其次,还要考虑与微藻生物质高值化利用结合的高效节能采收方式的选择。笔者主要通过介绍燃煤电厂微藻烟气固碳减排技术的机理和研究现状,提出了基于燃煤电厂余热、余压综合利用的微藻烟气固碳减排及微藻生物质采收集成系统,旨在为今后的电厂烟气绿色减排技术提供新思路。
1 微藻烟气固碳及减排机理
1.1 微藻光合固碳
微藻包括真核微藻和原核微藻2类,如蓝藻、绿藻、硅藻、甲藻、定鞭金藻、红藻、褐藻等[21]。藻细胞内主要含有蛋白质、油脂、碳水化合物等生化组分,藻种不同,其形态结构及各组分含量也不同(表1[23])。如Chlorella vulgaris为细胞直径2~10 μm的球状形态,而Spirulina platensis呈圆柱形螺旋丝状体,单细胞直径为5~10 μm,而藻丝长度可达500 μm[22]。微藻光合自养利用太阳能固定CO2的效率及生长速率可达陆生植物的5~10倍,不与粮食作物争地,可在淡水、海洋、盐碱湖及生活和工农业废水等多种水环境下生长。
表1 常见藻种的形态及生化组分含量
Table 1 Morphology and contents of common algae species
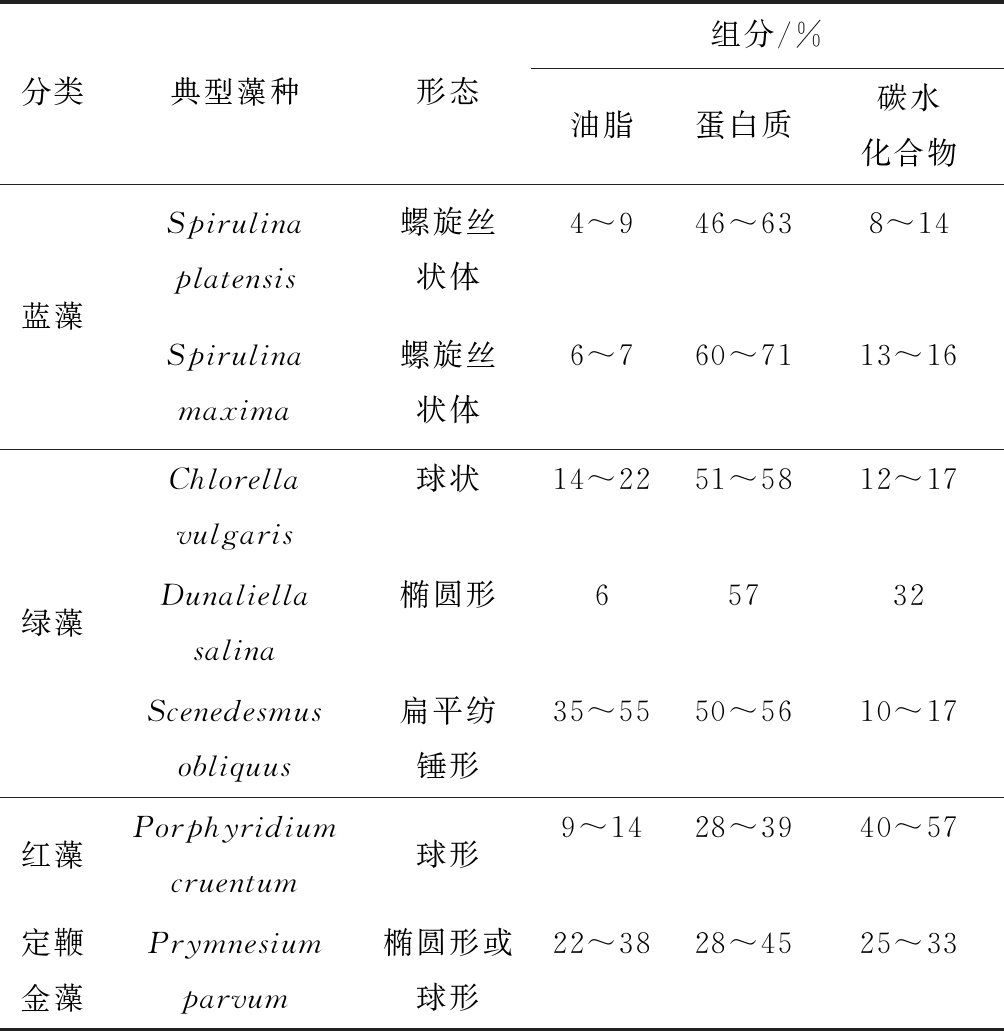
分类典型藻种形态组分/%油脂蛋白质碳水化合物蓝藻Spirulinaplatensis螺旋丝状体4~946~638~14Spirulinamaxima螺旋丝状体6~760~7113~16Chlorellavulgaris球状14~2251~5812~17绿藻Dunaliellasalina椭圆形65732Scenedesmus obliquus扁平纺锤形35~5550~5610~17红藻Porphyridiumcruentum球形9~1428~3940~57定鞭金藻Prymnesiumparvum椭圆形或球形22~3828~4525~33
碳是微藻的主要元素,含碳量约为干基生物质的36%~65%[6],燃煤电厂烟气中的CO2可作为生产微藻生物质的潜在来源,1 kg微藻生物质可固定1.3~2.4 kg的CO2[24]。微藻对烟气中CO2的去除包括通过光合作用合成细胞内的有机物和溶解在微藻悬浮液中,如图1所示。当烟气中CO2通入微藻悬浮液时,溶液中无机碳包括![]() 四种形式。其中,CO2和
四种形式。其中,CO2和![]() 可通过藻细胞膜上的无机碳泵进入细胞内,并由细胞质传输至叶绿体(真核微藻)或羧酶体(原核微藻)中,然后在碳酸酐酶(CA酶)的催化作用下转化为CO2,形成局部的高浓度CO2。为了保障光合作用卡尔文循环中充足的CO2供应,微藻经过亿万年的演化形成碳浓缩机制(CCM),可以将羧酶体位点的CO2浓度提高到周围环境的1 000倍[25]。最后在1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)的催化作用下与五碳糖相结合,形成磷酸甘油酸,实现卡尔文循环过程中碳的固定。卡尔文循环是微藻光合作用的重要组成部分,烟气中的CO2最终将被微藻固定为细胞内的有机物,并通过能源转化技术获得多种高附加值产品。此外,
可通过藻细胞膜上的无机碳泵进入细胞内,并由细胞质传输至叶绿体(真核微藻)或羧酶体(原核微藻)中,然后在碳酸酐酶(CA酶)的催化作用下转化为CO2,形成局部的高浓度CO2。为了保障光合作用卡尔文循环中充足的CO2供应,微藻经过亿万年的演化形成碳浓缩机制(CCM),可以将羧酶体位点的CO2浓度提高到周围环境的1 000倍[25]。最后在1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)的催化作用下与五碳糖相结合,形成磷酸甘油酸,实现卡尔文循环过程中碳的固定。卡尔文循环是微藻光合作用的重要组成部分,烟气中的CO2最终将被微藻固定为细胞内的有机物,并通过能源转化技术获得多种高附加值产品。此外,![]() 离子也可以被某些蓝藻利用,但只有
离子也可以被某些蓝藻利用,但只有![]() 能在细胞质中积累,且再被Rubisco利用前需要转化为CO2[26]。
能在细胞质中积累,且再被Rubisco利用前需要转化为CO2[26]。

图1 微藻光合固碳机理
Fig.1 Mechanism of photosynthetic carbon fixation in microalgae
1.2 微藻减排NOx
燃煤电厂烟气中的NOx主要包括NO和NO2,其中NO占90%~95%、NO2占5%~10%[27]。此外,烟气中还含有少量的N2O3、N2O4、N2O及N2O5。煤中氮的存在形态以有机氮为主,主要包括吡啶、吡咯型氮和季铵氮。在燃煤电厂的煤粉燃烧过程中,NOx的形成包括3条途径:①煤中有机氮在高温火焰中发生热分解,并进一步氧化形成NOx,即燃料型。②煤燃烧时空气中的氮和氧在高温下发生化合反应生成NOx,即热力型。③燃料中的碳氢基团(—CH等)与空气中的N2反应生成HCN等中间产物,然后与火焰中形成的O、—OH等基团反应形成氮氧化物,即快速型。NOx的生成与电厂锅炉结构、炉内温度、燃烧设备、燃煤种类和运行方式等有关[28]。
氮是微藻细胞生长和代谢所需的重要营养物质,约占细胞干重的10%。微藻可利用的无机氮源包括硝酸盐、亚硝酸盐、铵盐等。微藻减排NOx机理如图2所示,微藻对烟气中NOx的去除包括2种途径:NO、NO2通过扩散直接进入细胞内和NO、NO2溶于微藻悬浮液中形成硝酸根、亚硝酸根,然后被微藻吸收利用。NO和NO2溶于水时,将发生如式(1)至(4)的反应。
2NO2+H2O=HNO3+HNO2
(1)
4NO2+2H2O+O2=4HNO3
(2)
2NO+O2=2NO2
(3)
4NO+2H2O+3O2=4HNO3
(4)
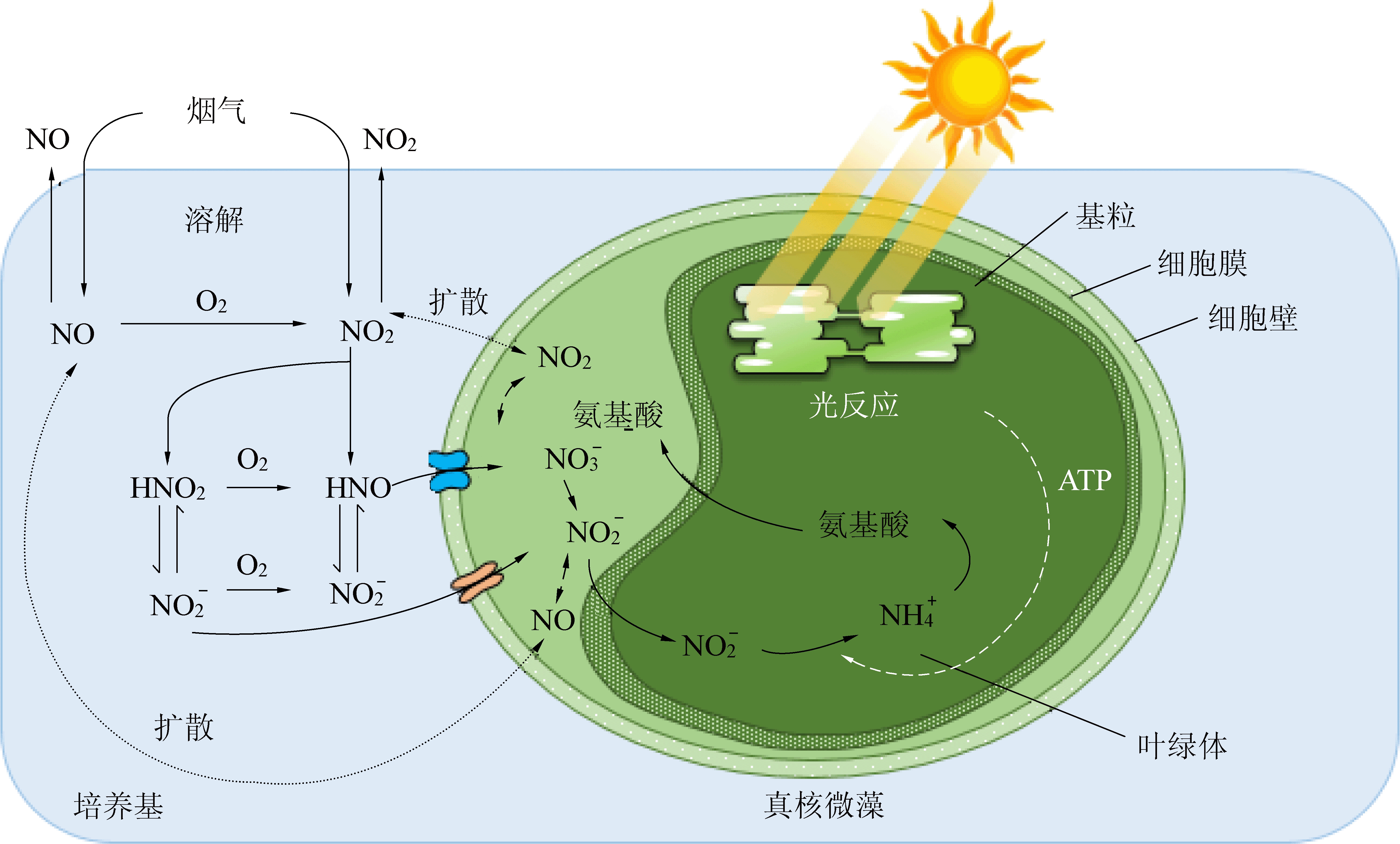
图2 微藻减排NOx机理
Fig.2 Mechanism of NOx reduction by microalgae
一方面,通过扩散作用进入细胞内的NO、NO2将在细胞质中被转化为亚硝酸根及硝酸根[6]。另一方面,烟气溶于水后形成的亚硝酸根及硝酸根将通过细胞膜上的转运蛋白运输至细胞内。此时,细胞质内的亚硝酸根和硝酸根一部分在细胞质内被转化为铵根,且多余的氮源被转运至液泡中储存,而另一部分则被转运至叶绿体中,并在酶的催化作用下还原为铵根。其后,通过一系列的生化反应将铵根同化为氨基酸、核苷酸、叶绿素等含氮细胞大分子物质有机骨架。但NO在常温常压下的溶解度仅为32 mg/L,是NO2的1/6 000[29],即NO难溶于水,NO在水中的溶解度是微藻去除NO速率的限制步骤。故为了提高NO在藻液中的溶解速率,需要加强NO的传质速率,如提高气体在溶液中的停留时间及增加气液接触面积等。同时,微藻对NO的去除还与悬浮液中溶解氧的浓度有关。此外,还可以向溶液中添加能够吸收NO形成稳定金属配合物的螯合物,如乙二胺四乙酸铁(Fe(II)EDTA)、乙二胺四乙酸(EDTA)、硝基三乙酸(NTA)和二巯基丙磺酸(DMPS)。但微藻悬浮液中光合作用产生的溶解氧和光照对螯合剂稳定性的影响等问题仍需要进一步研究[30]。
1.3 微藻减排SOx
燃煤电厂烟气中的SOx包括SO2和SO3,煤中的硫在燃烧时绝大部分转变为SO2,而少量转化为SO3。硫在煤中的形态包括无机硫(黄铁矿硫、硫酸盐硫等)、有机硫和元素硫。随着煤燃烧温度升高,其结构被破坏并挥发出无机硫和有机硫。无机硫和部分有机硫在高温下分解,产物被氧化为SO2、SO3。部分有机硫在还原性气氛下以H2S或COS的形态被释放出,然后被氧化为SO2。此外,由于火焰高温区内氧分子离解成氧原子、受热面积灰和金属氧化膜的催化作用,导致SO2转化为SO3。影响SOx生成的主要因素包括燃煤种类、过剩空气系数和燃烧温度等。
硫元素是藻细胞内多种功能性化合物的基本组成元素,如半胱氨酸、蛋氨酸、含硫类囊体脂质和辅酶因子等[31],占淡水藻类干重的0.15%~1.96%[32]。当烟气中SOx溶于水时,将发生如式(5)至(9)的反应,即烟气中的SO2和SO3被转化为亚硫酸根或硫酸根。如图3所示,微藻对烟气中SOx的吸收主要是通过细胞膜上的转运系统将溶液中硫酸根输送至细胞内,再在叶绿体中,将硫酸根还原为5'-腺苷酸(APS)、亚硫酸根和硫化物,然后直接与氨基酸(如半胱氨酸)结合。细胞内多余的硫酸根将被储存在液泡中。此外,当较高浓度的亚硫酸氢盐转化为硫酸盐时,将形成超氧阴离子、羟基自由基和过氧化氢等高度氧化的分子,导致膜脂过氧化和叶绿素漂白,抑制藻细胞生长。
SO2+H2O=H2SO3
(5)
2SO2+O2=2SO3
(6)
SO2+NO2=SO3+NO
(7)
SO3+H2O=H2SO4
(8)
2H2SO3+O2=2H2SO4
(9)

图3 微藻减排SOx机理
Fig.3 Mechanism of SOx reduction by microalgae
1.4 微藻减排重金属
煤炭中含有重金属元素,如Hg(0.01~0.50 mg/kg)、
Mn(0.256~0.389 mg/kg)、Cr(0.214~0.267 mg/kg)、
Cd(0.036~0.043 mg/kg)、As(0.016~0.018 mg/kg)、Ni(0.064~0.067 mg/kg)、Pb(0.013~0.017 mg/kg)等[33,34]。当煤在炉膛中高温燃烧时,煤中含有的挥发性重金属元素将会蒸发,导致烟气中存在微量重金属元素或其氧化物。同时,Fe和痕量元素等易在细微颗粒物中富集,形成具有高毒性的亚微米颗粒物[35]。除了碳、氮等主要营养元素外,微藻生长过程也需要一些微量元素,如合成色素和催化光合反应的Mg,组成铁氧化还原蛋白的Fe等。此外,无论是具有生物活性还是灭活的藻细胞都能吸收固定大部分金属离子,如Cu、Pb、Zn、Cr、Mn、Ni等[36]。但当烟气中重金属浓度过高时,其毒性将破坏藻细胞中蛋白质结构和细胞膜的完整性,或置换生物分子中的基本金属离子,破坏生物酶的合成,减弱光合作用,进而抑制微藻生长[37]。微藻吸附重金属机理如图4所示,为了减弱重金属对微藻的不利影响,藻细胞发展出多种对有毒金属的抗性机制,如物理吸附、离子交换、化学吸附、络合和螯合等胞内胞外的金属结合机制[38]。

M—金属离子;E—可交换离子;nBL—生物质结合位点;BE—含有可交换离子的生物分子; BM—含有金属离子的生物分子;M(BL)n—含有金属离子的络合物
图4 微藻吸附重金属机理
Fig.4 Adsorption mechanism of heavy metals by microalgae
微藻对烟气中重金属的去除机制包括被动吸附和主动吸附过程。被动吸附过程中,由于藻细胞表面存在的多糖、蛋白质或脂质等物质成分中含有不同类型的负电结合基团,如羟基(—OH)、磷酸基(—PO3)、羧基(—COOH)、巯基(—SH)、胺基(—NH2)等[39],故通过静电相互作用可使金属离子被动地吸附在细胞表面。该过程进行速度较快且可逆,能够发生在活性细胞及灭活细胞中。主动吸附过程是细胞的新陈代谢过程,即烟气中的金属离子通过细胞膜上的运载体运输至细胞内,然后与细胞内特定化合物结合,形成金属硫蛋白或植物螯合蛋白等有机金属复合物[40],或转运到特定的细胞间隔中(如液泡或聚磷酸盐体)[41]。而当金属的吸收量超过藻细胞的需求时,为克服微藻细胞内过量重金属对细胞正常新陈代谢的影响,可通过主动转运将其回流到溶液中[42]。主动吸附过程进行速度缓慢且不可逆,只能发生在活性细胞中[43]。藻种、生物量浓度、温度、pH值、初始金属浓度和金属形态等均会对微藻吸附重金属特性产生显著影响。虽然,微藻去除烟气中重金属的方法相比于传统的物理化学法具有投资和运行成本低、污染小、对化学品的需求少及效率高等优点,但如果微藻吸收过量重金属将不利于后期基于微藻生物质的保健品、化妆品、动物饲料等高值产品的生产。
2 微藻烟气固碳减排进展
2.1 藻种筛选
由于微藻对培养环境的pH有一定的耐受范围,而烟气中含有CO2、NOx、SOx等酸性气体,当较高浓度的CO2、NOx、SOx用于微藻培养时,会导致培养基pH值降低,不利于微藻生长。通常,淡水真核藻类适宜在pH 5~7的酸性环境下生长,而原核蓝藻适宜pH 7~9的碱性环境[44]。同时,烟气中重金属浓度过高也会对微藻生长产生毒害作用。所以,烟气处理过程中,应当选择可耐受较高浓度CO2、NOx、SOx、重金属等烟气成分的高生长速率、高固碳效率藻种。
当大量CO2溶解在培养基中时,藻液的pH值降低,导致藻细胞中酶活性降低,抑制微藻的生长代谢过程,进而降低光合作用效率。此时,细胞内的生化组份(蛋白质、油脂、碳水化合物、色素等)、碳酸酐酶和硝酸还原酶的活性等也会发生变化,且藻种不同,变化程度也不同[45]。即不同藻种对CO2的耐受程度不同,大多数微藻在1%~5%的CO2条件下能够良好生长,而一些微藻在高浓度CO2条件下才能快速生长,如蓝藻、栅藻和小球藻等[46]。部分微藻还能耐受20%~50%的高浓度CO2,如绿藻Chlorocuccum littorale、布朗葡萄藻Botryococcus braunii等[47、48]。Sakai等[49]分离筛选出的藻种Chlorella H-84能够在42 ℃的高温下生长,且可耐受40%的CO2的生长环境。
浓度低于100×10-6的NOx和50×10-6的SOx培养环境对微藻Chlorella sp.、Dunaliella Tertiolecta、Scenesdesmus obliquus的生长没有显著影响,但当烟气中含有较高浓度的NOx和SOx时,需要对烟气进行预处理[50]。SOx溶于水后形成的亚硫酸氢盐和硫酸盐对藻类生长有抑制作用[51]。Wodzinsk等[52]研究表明,当pH为6.0时,0.1 mmol/L的亚硫酸氢盐几乎完全抑制了蓝藻的光合作用,但对真核藻类无显著影响。Baker等[53]研究发现当pH值为7时,100 μg/mL亚硫酸盐对Ankistrodesmus sp.的生长无显著影响,但在pH为5时却几乎完全抑制了其生长,且pH值为7时Hg对光合作用的抑制作用强于pH为5的情况。即亚硫酸氢盐和Hg对微藻的毒性在酸性条件下被增强。亚硫酸氢盐对微藻的影响与藻种、pH值及亚硫酸氢盐浓度有关。Jiang等[54]采用CaCO3调节pH值并维持在7左右,使Scenedesmus dimorphus在15%的CO2,400×10-6的SO2,300×10-6的NO模拟烟气中生长良好(3.20 g/L)。Lee等[55]研究发现Chlorella sp.KR-1在15%的CO2和60×10-6的SO2条件下的生长速率为1.24 g/L/d,且能在15%的CO2条件下耐受100×10-6的SO2或100×10-6的NO的生长环境。对重金属而言,能够吸附重金属离子的微藻种类很多,如小球藻(Chlorella sp.)、螺旋藻(Spirulina sp.)、栅藻(Scenedesmus sp.)、裂丝藻(Stichococcus sp.)、褐指藻(Phaeodactylum sp.)和毛枝藻(Stigeoclonium sp.)等[36]。为了提高微藻对烟气中CO2、NOx、SOx或重金属的耐受程度,除了选择合适的藻种外,还可以对烟气进行稀释,降低污染物的浓度,或对微藻进行长期的适应性驯化培养,以及对藻种进行基因改造工程或采用物理/化学诱变技术形成微藻突变体(耐高温、耐酸碱、高油脂或高蛋白含量等)以适应烟气的培养环境。Chiu等[56]采用化学诱变方法获得菌株Chlorella sp.MTF-7,其在25%的CO2,80×10-6的NO,90×10-6的SO2烟气条件下经6天生长的生物质浓度达2.4 g/L。Cheng等[57]采用核辐射诱变筛选的Spirulina ZJU9000突变体在通空气培养条件下最大生物质浓度可达3.8 g/L,与野生型相比增加了310%,同时经过15%的CO2的驯化培养,生物质浓度由初代的0.45 g/L逐渐增加到第8代的2.74 g/L。而Cheng等[58]通过在模拟烟气中驯化培养Chlorella sp.AE10,使其能够耐受10%的CO2、200×10-6的NOx、100×10-6的SOx生长环境,且培养7天后获得生物质浓度3.4 g/L。部分可在烟气条件下适宜生长的藻种见表2。
表2 适用于烟气固碳减排的部分藻种
Table 2 Several strains of microalgae for flue gas carbon fixation and emission reduction

藻种筛选方法培养条件生长速率或生物质浓度文献Botryococcus braunii 765—20%CO22.31 g/L[47]Chlorocuccum littorale—50%CO20.50 g/dm3[48]Chlorella H-84分离筛选20%CO20.24 h-1[49]Scenedesmus dimorphus分离筛选15%CO2,400×10-6 SO2,300×10-6NO3.20 g/L[54]Chlorellasp.KR-1分离筛选15%CO2,100×10-6SO20.78 g/L/d[55]NannochloropissOZ-1—15%CO2,10×10-6Pb2+3.32 g/L[36]NannochloropissOZ-1—15%CO2,20×10-6As3+2.62 g/L[36]Chlorellasp.MTF-7化学诱变25% CO2,80×10-6NO,90×10-6SO22.4 g/L(0.37 g/L/d)[56]
续表

藻种筛选方法培养条件生长速率或生物质浓度文献SpirulinaZJU9000核辐射诱变+驯化15% CO22.74 g/L[57]Chlorellasp.AE10驯化10% CO2,200×10-6 NOx,100×10-6 SOx3.4 g/L[58]
2.2 光生物反应器
光生物反应器是微藻固碳生长的主要场所,为微藻生长提供适宜的光照、CO2、营养物质等。光生物反应器包括开放式和封闭式2种形式,见表3。开放式光生物反应器(如跑道池、循环池等)结构简单、易放大、操作方便且成本较低,但其占地面积大、参数可控性差、易受细菌及原生生物污染、水分蒸发大、光能利用率低。封闭式光生物反应器(如管式、平板式、柱式等)则具有参数易控、占地小、污染少、光能利用率高等优点,但存在结构复杂、成本高、难放大等问题。通常,开放式光生物反应器主要用于微藻的工业化培养,而封闭式光生物反应器主要用于实验室或小规模培养。为了提高藻细胞的光能利用率和CO2与藻液的气液传质效率,实现微藻的高密度培养,高效光生物反应器的设计和优化对于微藻培养的工业化发展至关重要。Kao等[59]进行了微藻Chlorella sp.MTF-15室外固碳减排电厂烟气(24%CO2,3%~6%O2,(25~30)×10-6NOx,(15~20)×10-6SO2等)的试验,采用24个总体积共1 200 L的柱式光生物反应器阵列处理烟气,CO2、NOx、SO2的去除率分别为50%、80%、93%,并获得
表3 微藻光生物反应器的特点[64,65]
Table3 Characteristics of microalgae photobioreactors

反应器类型优点缺点开式跑道池结构简单、成本低、操作方便、易放大占地面积大、参数可控性差、易污染 、水分蒸发大、混合不均闭式管式光照比表面积大、适于户外培养细胞贴壁、占地面积大、两相流阻较大、氧解析难平板式结构简单、光照比表面积大、易清洗、氧解析快光程短、不易控温及放大、成本高柱式传质效率高、混合均匀、剪切力小光照比表面积小、成本高袋式成本低、节省空间、可折叠移动混合不均、二次污染
0.792 g/L的微藻油脂产量,证实了利用微藻减排烟气污染物和生产生物质获得生物柴油的潜力。Sun等[60]为了减弱光衰减对微藻生长的不利影响,将空心PMMA(聚甲基丙烯酸甲酯)管嵌入平板光生物反应器中,使反应器内部平均光强提高2.0~6.5倍,生物质产量提高了23.42%。Pham等[61]设计了水动力特性良好的X型光生物反应器,其生物量和油脂产量分别提高了30.05%和23.49%。Cheng等[62]在跑道池中设置交替排列的锥形挡板以产生垂直和水平涡流来强化混合和气液传质,使螺旋藻生物量提高39.6%。近年来,聚乙烯、聚四氟乙烯等材料制造的袋式反应器也越来越受到人们的重视,其具有节省空间、成本低、可折叠移动等特点。此外,还可将多种传统光生物反应器的特点相结合,研制混合反应器,以提高微藻的生物质产率[63]。
2.3 曝气方式
烟气中CO2在水中的扩散速率很低,仅为在大气中的万分之一[25]。为了提高微藻烟气固碳减排的效率,需要增强CO2和藻液的气液传质。根据双膜理论,气泡中CO2向藻液的传递过程分为2个阶段,CO2分子由气泡中的气相主流区传递到气液界面附近的薄气膜区,然后再经过气液界面扩散到气液界面附近的薄液膜区,最后从薄液膜区传递到液相主流区,再通过藻细胞膜上的无机碳泵传递到细胞内,为微藻光合作用提供所需碳源。CO2向藻液的传递过程中CO2分子需要跨过薄气膜和薄液膜两层膜,其传质阻力主要为薄气膜和薄液膜区之间的传递阻力[66]。另外,CO2的传质速率还与传质系数、有效传质面积和气体成分浓度梯度等有关。为了强化传质速率,可采用机械搅拌、减小气泡直径及增大传质气体浓度梯度等方法。其中,曝气器的应用既可以改变气泡直径的大小,增加气液传质比表面积,又能够实现藻液的搅拌混合,减小气液膜间的传质阻力。在光生物反应器中,曝气器的结构和曝气方式是微藻固碳效率的影响因素[67]。曝气器的作用是产生含有烟气混合气体的气泡,为微藻生长提供碳源或氮源,并通过气泡的运动上升过程使藻液得到搅拌混合,加强了微藻的闪光效应。改变曝气器的结构,可以改变气泡的生成时间、生成直径、上升速度、气泡分布、混合时间等,而小气泡的生成可以增大气液接触的比表面积,减小上升速度和混合时间,延长气体停留时间,从而强化气液传质过程。曝气器的形式见表4,Yang等[68]为了提高跑道池中的气液传质系数和微藻的生长速率,研发了一种新型的摇摆式曝气器以产生小气泡,使气泡生成时间减少21%,混合时间减小,气液传质系数增大,生物质产量增加18%。Hu等[69]设计了一种条式曝气器,研究了孔径、孔间距、通气速率等对气液传质系数的影响,发现曝气器孔径0.3~1.0 mm条件下,气泡直径为1.38~3.11 mm,曝气压降低于7 kPa,传质系数达3.05~14.57 h-1,对微藻的生长固碳具有很好的促进作用。Zimmerman等[70]通过在反应器中使用新型的流体振荡器来驱动微泡的生成,从而降低气泡直径,避免气泡聚并,增加气泡停留时间,实现了高传质速率。烟气中难溶气体成分NO也能通过曝气器的作用增加气液接触面积,延长气泡停留时间,增强传质。此外,曝气器生成的气泡在藻液中产生的剪切力较小,不易损伤藻细胞。故曝气器结构的设计和优化有利于微藻烟气固碳减排效率的提高。
表4 曝气器的形式
Table 4 Forms of aerators
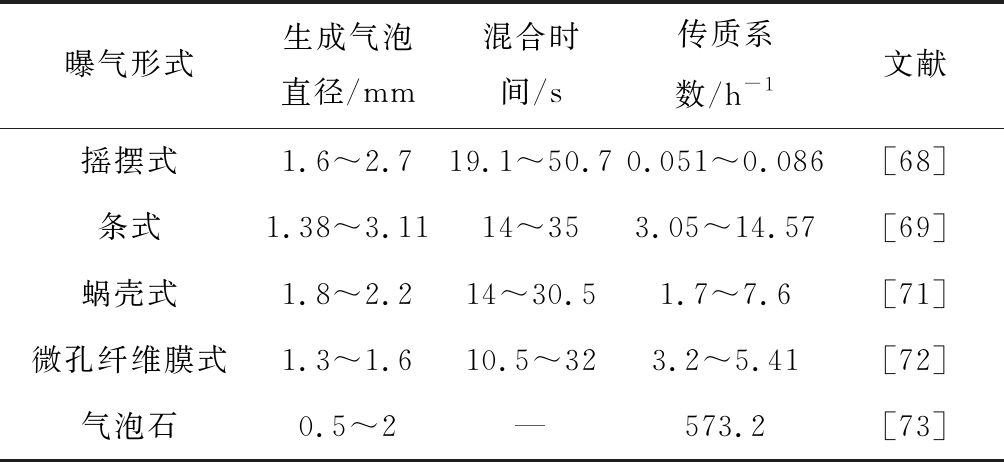
曝气形式生成气泡直径/mm混合时间/s传质系数/h-1文献摇摆式1.6~2.719.1~50.7 0.051~0.086[68]条式1.38~3.1114~353.05~14.57[69]蜗壳式1.8~2.214~30.51.7~7.6[71]微孔纤维膜式1.3~1.610.5~323.2~5.41[72]气泡石0.5~2—573.2[73]
3 微藻烟气固碳减排及微藻生物质采收集成系统
固碳减排积累的微藻细胞经采收、干燥处理后,可用于提取高附加值产物(如叶黄素、虾青素等)及转化制取生物质燃料(如柴油、甲烷、乙醇等)。由于微藻细胞直径小,在培养液中的浓度较低(0.5~2.0 g/L),密度与水相近,且细胞表面带负电荷,在溶液中呈稳定的分散状态,导致采收难度较大[74]。通常需要通过絮凝、离心、过滤或气浮等方法进行采收浓缩微藻细胞,过程能耗约占相关微藻生产总成本的20%~30%[75]。而采收后获得的生物质还需要进行干燥处理,其后才能进行高附加值产品的后续生产,该过程消耗的热量可超过微藻含能量的50%[76]。另外,随着室外环境温度的变化,为保证微藻适宜的生长条件,光生物反应器的温度控制也至关重要,而加热反应器需要消耗微藻含能量的36%~59%[76]。
所以,为了进一步提高微藻烟气固碳减排及微藻生物质采收集成系统的总体经济可行性,可将电厂烟气的余热、余压利用集成到系统中,微藻烟气固碳减排及微藻生物质采收集成系统如图5所示。该系统中,烟气中的CO2、NOx、SOx、重金属等为微藻光合自养生长提供了碳源、氮源、微量元素等营养物质,微藻进行光合自养生长的同时实现了烟气污染物的固碳减排。利用烟气余压则可采用过滤法、气浮法等对微藻进行分离浮选。而烟气余热不仅可以用于藻体的干燥处理,为后续产品的生产过程提供前提,而且还能用于反应器内培养温度的控制。此外,为了减少系统中微藻培养的淡水需求,可将市政或农业污水集成到系统中,实现污水净化处理的同时获得微藻生长所需的丰富水源、氮源、磷源、微量元素等营养物质。燃煤电厂烟气余热、余压利用耦合微藻烟气固碳及微藻生物质采收的集成系统旨在降低微藻培养及生物质采收、干燥处理过程中的能耗及成本,实现系统的可持续性发展。

图5 微藻烟气固碳减排及微藻生物质采收集成系统
Fig.5 Integrated system of carbon fixation and emission reduction and biomass harvesting of microalgae from coal-fired flue gas
4 结 语
微藻通过光合作用固定燃煤电厂烟气中的CO2,并减排NOx、SOx、重金属等污染物,同时获得可生产高附加值产品的微藻生物质,具有未来的规模化应用潜力。但由于烟气中CO2、NOx的气液传质阻力较大,且烟气中高浓度的CO2、NOx、SOx、重金属等物质对微藻生长有抑制作用,需要设计高效光生物反应器和曝气器结构,同时通过诱变、驯化等途径筛选获得耐酸、耐重金属及高生长速率的藻种。此外,将电厂烟气的余热、余压及废水处理与微藻烟气减排技术结合,实现微藻培养、采收、烘干、烟气减排、废水净化等系统集成,具有很好的经济可行性与环境效益,为燃煤烟气绿色减排提供新思路。
[1] 李春梅.BP世界能源展望(2018年版)发布[J].中国能源,2018,40(4):47.
LI Chunmei.BP world energy outlook (2018 edition) released[J].China Energy,2018,40(4):47.
[2] 国家统计局.中华人民共和国2018年国民经济和社会发展统计公报[N].人民日报,2019-03-01(10).
[3] 岳 勇,陈 雷,姚 强,等.燃煤锅炉颗粒物粒径分布和痕量元素富集特性实验研究[J].中国电机工程学报,2005,21(18):74-79.
YUE Yong,CHEN Lei,YAO Qiang,et al.Experimental study on particle size distribution and trace element enrichment characteristics of coal-fired boilers[J].Chinese Journal of Electrical Engineering,2005,21(18):74-79.
[4] 徐明厚,郑楚光,冯 荣,等.煤燃烧过程中痕量元素排放的研究现状[J].中国电机工程学报,2001,21(10):34-39.
XU Minghou,ZHENG Chuguang,FENG Rong,et al.Research status of trace element emission in coal combustion[J].Chinese Journal of Electrical Engineering,2001,21(10):34-39.
[5] 赵永椿,马斯鸣,杨建平,等.燃煤电厂污染物超净排放的发展及现状[J].煤炭学报,2015,40(11):2629-2640.
ZHAO Yongchun,MA Siming,YANG Jianping,et al.Development and current situation of ultra-clean pollutant emission from coal-fired power plants[J].Journal of China Coal Society,2015,40(11):2629-2640.
[6] VAN D H S,VERVAEREN H,BOON N.Flue gas compounds and microalgae:(Bio-)chemical interactions leading to biotechnological opportunities[J].Biotechnology Advances,2012,30(6):1405-1424.
[7] 杜玉颖,孙永斌,詹 扬,等.燃煤电站超低排放控制技术设计方法与图谱[J].环境工程,2018,36(3):92-97.
DU Yuying,SUN Yongbin,ZHAN Yang,et al.Design method and atlas of ultra-low emission control technology for coal-fired power stations[J].Environmental Engineering,2018,36(3):92-97.
[8] 杨祥花,段钰锋,江贻满,等.燃煤锅炉烟气和飞灰中汞形态分布研究[J].煤炭科学技术,2007,35(12):55-58.
YANG Xianghua,DUAN Yufeng,JIANG Yiman,et al.Study on the distribution of mercury in flue gas and fly ash from coal-fired boilers[J].Coal Science and Technology,2007,35(12):55-58.
[9] 王禺昊,董众兵.燃煤飞灰热处理过程中重金属挥发特性研究[J].煤炭科学技术,2018,46(11):221-226.
WANG Yuhao,DONG Zongbing.Volatilization characteristics of heavy metals during heat treatment of coal fly ash[J].Coal Science and Technology,2018,46(11):221-226.
[10] 《全面实施燃煤电厂超低排放和节能改造工作方案》[J].节能与环保,2016(1):32.
Comprehensive implementation of work plan for ultra-low emission and energy-saving transformation of coal-fired power plants[J].Energy conservation and environmental protection,2016(1):32.
[11] 工业和信息化部规划司.《中国制造2025》的主要目标[N].中国电子报,2015-05-26(5).
[12] 梅 文.《煤炭工业发展“十三五”规划》印发[J].煤炭加工与综合利用,2017(1):18.
MEI Wen.Issuance of the 13th five-year plan for coal industry development[J].Coal processing and comprehensive utilization,2017(1):18.
[13] 尚庆雨.我国煤粉工业锅炉技术现状及发展趋势[J].煤炭科学技术,2016,44(1):201-206.
SHANG Qingyu.Status quo and development trend of coal powder industrial boiler technology in China[J].Coal Science and Technology,2016,44(1):201-206.
[14] NEGORO M,SHIOJI N,MIYAMOTO K,et al.Growth of Microalgae in High CO2 Gas and Effects of SOx and NOx[J].Applied Biochemistry and Biotechnology,1991,28(9):877-886.
[15] MAEDA K,OWADA M,KIMURA N,et al.CO2 fixation from the flue gas on coal-fired thermal power plant by microalgae[J].Energy Conversion and Management,1995,36(6-9):717-720.
[16] LEE J N,LEE J S,SHIN C S,et al.Methods to enhance tolerances of Chlorella KR-1 to toxic compounds in flue gas[J].Applied Biochemistry and Biotechnology,2000,84(6):329-342.
[17] WESTERHOFF P,HU Q,ESPARZA-SOTO M,et al.Growth parameters of microalgae tolerant to high levels of carbon dioxide in batch and continuous-flow photobioreactors[J].Environmental Technology,2010,31(5):523-528.
[18] MATA T M,MARTINS A A,CAETANO N S.Microalgae for biodiesel production and other applications:A review[J].Renewable and Sustainable Energy Reviews,2010,14(1):217-232.
[19] NAPAN K,TENG L H,QUINN J C,et al.Impact of heavy metals from flue gas integration with microalgae production[J].Algal Research-Biomass Biofuels and Bioproducts,2015,8:83-88.
[20] CUI H J,YANG Z H,LU Z,et al.Combination of utilization of CO2 from flue gas of biomass power plant and medium recycling to enhance cost-effective Spirulina production[J].Journal of Applied Phycology,2019,31(4):2175-2185.
[21] HU Q,SOMMERFELD M,JARVIS E,et al.Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances[J].Plant Journal,2008,54(4):621-639.
[22] SHUBA E S,KIFLE D.Microalgae to biofuels:'Promising' alternative and renewable energy,review[J].Renewable & Sustainable Energy Reviews,2018,81:743-755.
[23] JANKOWSKA E,SAHU A K,OLESKOWICZ-POPIEL P.Biogas from microalgae:Review on microalgae's cultivation,harvesting and pretreatment for anaerobic digestion[J].Renewable and Sustainable Energy Reviews,2017,75:692-709.
[24] CHISTI Y.Biodiesel from microalgae[J].Biotechnology Advances,2007,25(3):294-306.
[25] PRICE G D,BADGER M R,WOODGER F J,et al.Advances in understanding the cyanobacterial CO2-concentrating-mechanism (CCM):functional components,Ci transporters,diversity,genetic regulation and prospects for engineering into plants[J].Journal of Experimental Botany,2007,59(7):1441-1461.
[26] MIKHODYUK O S,ZAVARZIN G A,IVANOVSKY R N J M.Transport systems for carbonate in the extremely natronophilic cyanobacterium Euhalothece sp[J],2008,77(4):412-418.
[27] ZHAO B T,SU Y X.Process effect of microalgal-carbon dioxide fixation and biomass production:A review[J].Renewable & Sustainable Energy Reviews,2014,31:121-132.
[28] 李 慧,周建明,刘 刚,等.煤粉空气分级燃烧过程中NOx排放特性试验研究[J].煤炭科学技术,2016,44(12):197-201.
LI Hui,ZHOU Jianming,LIU Gang,et al.Experimental study on emission characteristics of NOx in pulverized coal air fractional combustion[J].Coal Science and Technology,2016,44(12):197-201
[29] DORA J,GOSTOMCZYK M A,JAKUBIAK M,et al.Parametric studies of the effectiveness of oxidation of no by ozone[J].Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa,2009,30(4):621-633.
[30] JIN H F,SANTIAGO D E O,PARK J,et al.Enhancement of nitric oxide solubility using Fe(II)EDTA and its removal by green algae Scenedesmus sp[J].Biotechnology and Bioprocess Engineering,2008,13(1):48-52.
[31] BOROWITZKA M A,BEARDALL J,RAVEN J A J D I A P.The Physiology of Microalgae[J].Developments in Applied Phycology,2016.
[32] BAKER L A.Sulfur Cycling in an Experimentally Acidified Seepage Lake[C],1989.
[33] YEN H W,HO S H,CHEN C Y,et al.CO2,NOx and SOx removal from flue gas via microalgae cultivation:a critical review[J].Biotechnology Journal,2015,10(6):829-839.
[34] WANG S X,ZHANG L,LI G H,et al.Mercury emission and speciation of coal-fired power plants in China[J].Atmospheric Chemistry Physics Discussions,2010.
[35] 王 超.燃煤细颗粒物及痕量元素排放控制特性的试验研究与现场测试[D].武汉:华中科技大学,2015.
[36] 孙 晶.重金属影响微藻生长富集油脂的机理研究[D].杭州:浙江大学,2015.
[37] KAGALOU I,BEZA P P C,PETRIDIS D J F E B.Effects of copper and lead on microalgae (Isochrysis galbana) growth[J].Fresenius Environmental Bulletin,2002,11(5):233-236.
[38] SUD D,MAHAJAN G,KAUR M P.Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions - A review[J].Bioresource Technology,2008,99(14):6017-6027.
[39] ZERAATKAR A K,AHMADZADEH H,TALEBI A F,et al.Potential use of algae for heavy metal bioremediation,a critical review[J].Journal of Environmental Management,2016,181:817-831.
[40] PEREZ-RAMA M,HERRERO C,ABALDE J,et al.Class III metallothioneins in response to cadmium toxicity in the marine microalga Tetraselmis suecica (Kylin) Butch[J].Environmental Toxicology and Chemistry,2001,20(9):2061-2066.
[41] WORMS I,SIMON D F,HASSLER C S,et al.Bioavailability of trace metals to aquatic microorganisms:importance of chemical,biological and physical processes on biouptake[J].Biochimie,2006,88(11):1721-1731.
[42] MONTEIRO C M,CASTRO P M L,MALCATA F X.Metal uptake by microalgae:Underlying mechanisms and practical applications[J].Biotechnology Progress,2012,28(2):299-311.
[43] MUNOZ R,ALVAREZ M T,MUNOZ A,et al.Sequential removal of heavy metals ions and organic pollutants using an algal-bacterial consortium[J].Chemosphere,2006,63(6):903-911.
[44] RAZZAK S A,HOSSAIN M M,LUCKY R A,et al.Integrated CO2 capture,wastewater treatment and biofuel production by microalgae culturing-A review[J].Renewable & Sustainable Energy Reviews,2013,27:622-653.
[45] XIA J R,GAO K S.Impacts of elevated CO2 concentration on biochemical composition,carbonic anhydrase,and nitrate reductase activity of freshwater green algae[J].Journal of Integrative Plant Biology,2005,47(6):668-675.
[46] 周文广,阮榕生.微藻生物固碳技术进展和发展趋势[J].中国科学:化学,2014,44(1):63-78.
ZHOU Wenguang,RUAN Rongsheng.Progress and development trend of microalgae biosequestration[J].Science in China:Chemistry,2014,44(1):63-78.
[47] GE Y M,LIU J Z,TIAN G M.Growth characteristics of Botryococcus braunii 765 under high CO2 concentration in photobioreactor[J].Bioresource Technology,2011,102(1):130-134.
[48] OTA M,KATO Y,WATANABE H,et al.Fatty acid production from a highly CO2 tolerant alga,Chlorocuccum littorale,in the presence of inorganic carbon and nitrate[J].Bioresource Technology,2009,100(21):5237-5242.
[49] SAKAI N,SAKAMOTO Y,KISHIMOTO N,et al.Chlorella strains from hot springs tolerant to high temperature and high CO2[J].Energy Conversion Management,1995,36(6-9):693-696.
[50] LAM M K,LEE K T,MOHAMED A R.Current status and challenges on microalgae-based carbon capture[J].International Journal of Greenhouse Gas Control,2012,10:456-469.
[51] WODZINSKI R S,ALEXANDER M.Effect of Sulfur Dioxide on Algae[J].Environ.Qual,1978,7:3(3):358-360.
[52] WODZINSKI R S,LABEDA D P,ALEXANDER M.Toxicity of SO2 and NOx:Selective Inhibition of Blue-Green Algae by Bisulfite and Nitrite[J].Air Repair,1977,27(9):891-893.
[53] BAKER M D,MAYFIELD C I,INNISS W E,et al.Toxicity of pH,heavy metals and bisulfite to a freshwater green alga[J].Chemosphere,1983,12(1):35-44.
[54] JIANG Y L,ZHANG W,WANG J F,et al.Utilization of simulated flue gas for cultivation of Scenedesmus dimorphus[J].Bioresource Technology,2013,128:359-364.
[55] LEE J S,KIM D K,LEE J P,et al.Effects of SO2 and NO on growth of Chlorella sp KR-1[J].Bioresource Technology,2002,82(1):1-4.
[56] CHIU S Y,KAO C Y,HUANG T T,et al.Microalgal biomass production and on-site bioremediation of carbon dioxide,nitrogen oxide and sulfur dioxide from flue gas using Chlorella sp cultures[J].Bioresource Technology,2011,102(19):9135-9142.
[57] CHENG J,LU H X,HE X,et al.Mutation of Spirulina sp by nuclear irradiation to improve growth rate under 15% carbon dioxide in flue gas[J].Bioresource Technology,2017,238:650-656.
[58] CHENG D J,LI X Y,YUAN Y Z,et al.Adaptive evolution and carbon dioxide fixation of Chlorella sp.in simulated flue gas[J].Science of the Total Environment,2019,650:2931-2938.
[59] KAO C Y,CHEN T Y,CHANG Y B,et al.Utilization of carbon dioxide in industrial flue gases for the cultivation of microalga Chlorella sp[J].Bioresource Technology,2014,166:485-493.
[60] SUN Y H,HUANG Y,LIAO Q,et al.Enhancement of microalgae production by embedding hollow light guides to a flat-plate photobioreactor[J].Bioresource Technology,2016,207:31-38.
[61] PHAM H M,KWAK H S,HONG M E,et al.Development of an X-Shape airlift photobioreactor for increasing algal biomass and biodiesel production[J].Bioresource Technology,2017,239:211-218.
[62] CHENG J,GUO W,CAI C,et al.Alternatively permutated conic baffles generate vortex flow field to improve microalgal productivity in a raceway pond[J].Bioresour Technol 2017,249:212-218.
[63] VO H N P,NGO H H,GUO W,et al.A critical review on designs and applications of microalgae-based photobioreactors for pollutants treatment[J].Science of The Total Environment 2018,651:1549-1568.
[64] POSTEN C.Design principles of photo-bioreactors for cultivation of microalgae[J].Engineering in Life Sciences,2009,9(3):165-177.
[65] WANG B,LAN C Q,HORSMAN M.Closed photobioreactors for production of microalgal biomasses[J].Biotechnology Advances,2012,30(4):904-912.
[66] 赵 莎.微藻悬浮液中CO2气泡的动力学行为及固碳特性研究[D].重庆:重庆大学,2015.
[67] FU J,HUANG Y,LIAO Q,et al.Photo-bioreactor design for microalgae:A review from the aspect of CO2 transfer and conversion[J].Bioresource Technology,2019,292:121947-121947.
[68] YANG Z B,CHENG J,LIU J Z,et al.Improving microalgal growth with small bubbles in a raceway pond with swing gas aerators[J].Bioresource Technology,2016,216:267-272.
[69] 胡自明.气升式光生物反应器内CO2传递与微藻生长固碳强化[D].重庆:重庆大学,2018.
[70] ZIMMERMAN W B,HEWAKANDAMBY B N,TESAR V,et al.On the design and simulation of an airlift loop bioreactor with microbubble generation by fluidic oscillation[J].International Sugar Journal,2010,1334:90-103.
[71] CHENG J,MIAO Y,GUO W B,et al.Reduced generation time and size of carbon dioxide bubbles in a volute aerator for improving Spirulina sp growth[J].Bioresource Technology,2018,270:352-358.
[72] CHENG J,SONG Y M,GUO W B,et al.Developing microporous fibrous-diaphragm aerator to decrease bubble generation diameter for improving microalgal growth with CO2 fixation in a raceway pond[J].Bioresource Technology,2019,276:28-34.
[73] FALINSKI K A,TIMMONS M B,CALLAN C,et al.Response of Tisochrysis lutea Prymnesiophycidae to aeration conditions in a bench-scale photobioreactor[J].Journal of Applied Phycology,2018,30(4):2203-2214.
[74] BARROS A I,GONCALVES A L,SIMOES M,et al.Harvesting techniques applied to microalgae:A review[J].Renewable & Sustainable Energy Reviews,2015,41:1489-1500.
[75] RAWAT I,KUMAR R R,MUTANDA T,et al.Dual role of microalgae:Phycoremediation of domestic wastewater and biomass production for sustainable biofuels production[J].Applied Energy,2011,88(10):3411-3424.
[76] KOUHIA M,HOLMBERG H,SONCK M,et al.Energy analysis of algae-to-biofuel production chains integrated with a combined heat and power plant[J].International Journal of Sustainable Engineering,2019,12(4):281-290.
