0 引 言
煤层气作为一种非常规天然气的重要储备能源,主要有热成因和生物成因。其中生物成因的煤层气在世界范围内得到了广泛的关注,如美国的圣胡安盆地[1]、澳大利亚雪梨盆地[2]、日本北海道[3]、中国的沁水盆地部分区块与淮南地区等存在混合成因的煤层气藏[4];还有生物成因为主的煤层气藏,如美国的粉河盆地[5]、澳大利亚的苏拉特盆地[6]、中国新疆准南米泉地区等[7]。所有这些地区的煤层气均能够通过其同位素地球化学特征来证实生物成因气的存在,而大部分地区由于生物气所占比例有限,目前的判识标准还无法确定其存在。生物气,特别是次生生物气的最显著特点是其生成的持续性,在合适的环境下这类气体可以持续的生成,甚至于在煤层气开发过程中还在生成。因此,有可能大部分煤层气富集区,尤其是与地下水运移聚集相关的富集区,都会有生物气的贡献。近期在几乎所有的煤层中都检测出了产甲烷菌,无论是赋存热成因气还是生物成因气的煤层都存在不同类型和丰度的产甲烷菌,在漫长的地质演化过程中或多或少会产生一些生物气,更说明生物气生成的普遍性。因此,有学者提出了微生物强化煤层气产出(Microbial Enhanced CBM,MECBM)的理念[8],即将营养物质或含产甲烷菌群的营养液注入到煤层,通过厌氧发酵将煤的一部分转化为甲烷,由此提升煤层气井的产量。近年来煤厌氧发酵生产生物甲烷的研究取得了长足进展,对这一领域的关注度与日俱增。这些研究基本上可以概括为3个方面:生物甲烷的生成条件研究、产甲烷菌群的特征研究以及强化生物甲烷的产出研究。不少学者主要针对温度、pH、Eh、菌种接种量、本源/外源菌、煤的添加量、煤的粒径、微量元素进行了单因素和多因素的影响评价,基本确定了试验室厌氧发酵产甲烷的最优参数[6,9-11]。有机物在厌氧发酵生成甲烷的过程中涉及到水解酸化反应、产氢产乙酸反应和产甲烷化反应,需要依赖于各个发酵阶段的微生物共同作用[12],这也使得煤层气领域内的微生物生态学得到了广泛的发展。2007年SHIMIZU等[3]首次报道了日本北海道煤层气田微生物多样性研究,随后全球范围内的煤层气田和排采水中的微生物多样性也相继报道[13-15]。也有学者通过生物驯化、生物刺激和生物强化等来研究强化生物甲烷的产出[10,16-18],一方面通过驯化提高微生物对极端环境的适应性,添加目标微生物所需营养物质使其细胞代谢更为活跃、增强所需的代谢功能[19,20];另一方面是通过生物手段,如利用降解能力极强的真菌对煤进行预处理[21-23]或通过双氧水、高锰酸钾强氧化剂等化学手段预处理煤,增加了煤中可被微生物利用的物质在液相体系中的量[24-25],从而促进生物甲烷的产出。此外煤与生物质共降解近年来成为研究的热点[26-27],生物质中含有的糖类和蛋白质是煤中所欠缺的,适当地加入到煤中,在一定程度上能够促进微生物的生长代谢,提高生物甲烷的产量。工程应用方面在美国、澳大利亚等国家先后进行了工业试验。澳大利亚Apex公司在联合国能源署的资助下,在Sydney盆地尝试注入微生物进行煤层气开发先导性试验初有成效[28]。美国Luca Technologies公司于2006年在粉河盆地的260口煤层气井中注入营养液现场试验,平均每口试验井产气量比预期增加45 MCF(1 260 m3),试验井能恢复到历史峰值产气量的50%[29]。Ciris Energy公司于2012年在粉河盆地开始中试规模现场试验,通过向Antelope Valley 4口井注入产甲烷菌培养液,3个月后,周围13口废弃的煤层气井重新产气,单井产气2 000~4 000 m3/d[18]。Next Fuel公司在印度尼西亚的16口煤层气井进行营养液注入现场试验,产量也有所提升[30]。我国在这一领域的研究基本上与国际同步,2008年就开始了相关的探索,主要是在政府各类基金的资助下开展的试验室研究,基本上和国际的研究内容相似;个别单位在几个地区进行了现场试验,但由于缺乏对试验条件的优化和菌种的驯化,收效甚微。MECBM之所以逐渐受到各国政府和企业的重视,就是因为其潜在的增产能力,将有力推动中国煤层气商业化开发进程。
鉴于这一技术的工程意义,笔者将其定义为“煤层气生物工程(Coalbed Gas Bioengineering,CGB)”,是一种特殊的厌氧发酵工程,即采用现代工程技术手段,利用微生物的某些特定功能,把煤部分转化为煤层气和与之伴生的液相有机物的一种新技术。煤层气生物工程是一个多学科交叉、融合而形成的技术性和应用性较强的新兴边缘学科,涉及到微生物学、地球化学、地下水动力学、煤层气工程、石油化工工程、矿业工程和材料工程等学科(图1),主要内容包括上游的菌种的选育、培养基的优化、灭菌、扩大培养和接种,中游发酵过程参数的控制和下游产品的分离提纯与新产品的合成等方面,核心是上中游。CGB具体可概括为:将上游驯化培养出的优良菌种作为压裂液(生物压裂液)注入地下原始煤层或煤矿采空区;进入中游厌氧发酵阶段,将煤的一部分转化为以甲烷为主,还含有一定量重烃、氢气、氮气和二氧化碳等气体(生物煤层气);同时也生成种类繁多的类石油液相化工产品,可被抽出分离提纯利用。这些气液相物质中部分可以作为原材料合成新产品,如高硫煤生成的硫化氢合成纳米黄铁矿、生成的或后期注入的二氧化碳合成纳米方解石等,这是下游的任务。可见,煤层气生物工程涵盖了资源、环境和材料3大领域,其实施具有多重意义:①实现生物采煤、生物采残煤;②生成洁净的甲烷和氢气—增气;③生成各种各样的类石油液相产品—增液;④降低煤的亲甲烷能力—增解;⑤增加煤储层的孔裂隙度—增透;⑥二氧化碳甲烷化—减排;⑦二氧化碳矿化—埋存、固化采空区;⑧微生物脱除煤中的有机硫—环保。正是由于煤层气生物工程具有如此多的优点,才越来越受到关注。

图1 煤层气生物工程研究体系
Fig.1 Research framework of Coalbed Gas Bioengineering
前人大量的研究为煤层气生物工程这一新兴边缘学科的形成和发展做出了贡献,但是作为一个诞生到现在不足15年历史的全新研究领域,目前针对这一领域的系统概括与总结还不多见。笔者将对煤层气生物工程的内涵和外延进行系统的介绍,希望能够成为推动中国煤层气产业化进程的一条新途径,在新能源、新材料和温室气体减排等多方面获取效益,实现低碳经济的可持续发展。
1 煤层气生物工程的微生物学基础
自然界中细菌在适宜的环境条件下才能够生存和繁衍,就产甲烷菌而言其活跃的最佳温度是35~45 ℃,生存的上限是110 ℃[31]。因此,在正常地温下(地表温度15 ℃、地温梯度3 ℃/hm),煤储层埋深在600~1 000 m时是产甲烷菌活动最强烈的深度,其生存的最大深度可达2 000 m左右[32]。由此可见,生物成因的煤层气离不开微生物的代谢,无论是煤层中的原位微生物,还是实验室厌氧发酵系统中群落结构都是生物产气的微生物基础,也是煤层气生物工程的上游内容。同时生物成因煤层气的生成遵循经典厌氧发酵“四阶段”理论,煤作为一种复杂有机物,在微生物作用下转化成甲烷需要水解菌群、产酸发酵菌群、产氢产乙酸菌及产甲烷菌等多种微生物的共同作用。因此,深入探讨煤层环境中的微生物多样性以及生物成气的产气机制与影响因素很有必要,这也是煤层气生物工程的中游核心内容。
1.1 煤层(水)中微生物多样性
近年来在进行煤、富含有机质的页岩等厌氧发酵产甲烷试验时,着重探讨了与产甲烷有关的细菌和古菌的类型和特征,发现细菌多样性高于古细菌[33-34]。2007年,SHIMIZU等[3]首次报道了日本北海道煤层中的微生物多样性,通过地球化学方法测定了煤层气中的气体组成及稳定同位素,同时利用16S rRNA基因测序技术,查明了煤层中微生物的群落结构[3]。研究发现该地区的煤层气主要为热成因气,但产出水中存在氢营养型产甲烷囊菌属(Methanoculleus)和甲基营养型产甲烷叶菌属(Methanolobus),同时也检测出与产甲烷菌互养的细菌,而且发现产出水具有氢营养型和甲基营养型产甲烷能力。这一结果说明,该地区确有生物成因气,但目前的成因判别标准难以识别。随着16S rRNA基因测序技术的应用和普及,较多学者利用该技术在全球范围内对煤层和煤层水的微生物多样性进行了广泛研究。澳大利亚东部和美国Power River盆地煤层及产出水的微生物群落结构存在显著差异[35-36]。其中,澳大利亚东部煤层中的细菌群落主要以变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)为主,厚壁菌门中主要为梭菌目细菌(Clostridiales);古菌包含古球菌属(Archaeoglobus)和热球菌属(Thermococcus),而没有检测到产甲烷菌。Power River盆地中的细菌群落的优势菌群为放线菌门(Actinobacteria)和变形菌门(Proteobacteria),古菌群落包括Methanothrix和Methanosarcina。此外,在澳大利亚的Gippsland盆地煤层产出水中检测到甲烷杆菌属(Methaobacterium)的存在,细菌同样以变形菌门和厚壁菌门为主[14]。也有学者对原煤、原煤富集液以及煤层水富集液的微生物多样性进行了研究,例如,美国伊利诺伊盆地东部煤层产出水和富集培养液中的产甲烷菌都以甲烷粒菌属(Methanocorpusculu)为主,该地区的细菌包括α变形菌纲(α-Proteobacteria)、厚壁菌门(Firmicutes)、梭菌纲(Clostridia)和螺旋菌属(Spirochaetes);在新西兰的Waikato煤田的原煤中检测到的产甲烷菌包括甲烷八叠球菌目(Methanosarcinales)和甲烷杆菌目(Methanobacteriales),细菌包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)[37]。值得一提的是加拿大Alberta盆地原煤中只检测到细菌基因序列,而在原煤培养液中检测到大量的细菌和古菌,且原煤与富集培养液中的细菌群落存在较大差异,培养液中的古菌以甲烷八叠球菌(Methanosarcina)为主[38],这说明原煤中存在古菌,只是原始的煤层环境条件难以满足古菌大量繁殖,而在实验室培养基中其活性得以激活。
近年来国内对于煤层气田微生物多样性的报道日趋增多,如鄂尔多斯盆地的部分煤矿区煤中存在产甲烷菌和细菌,细菌以放线菌门(Actinobacteria)和变形菌门(Proteobacteria)为主,古菌以甲烷囊菌属(Methanoculleus)和甲烷八叠球菌属(Methanosarcina)为主[15]。苏现波等[34]研究了中国10个代表性矿区的煤中微生物的多样性,采集样品基本构成了一个相对完整的煤阶系列,有低煤阶烟煤(内蒙古乌兰图嘎C7)、中煤阶烟煤(义马常村C1,柳林沙曲C3,霍州李雅庄C2,宿州祁东C6,平顶山四矿C10)、高煤阶烟煤(鹤壁四矿C4,首山一矿C9)和无烟煤(晋城赵庄C5,焦作九里山C8)。结果表明在已知有生物成因煤层气的地区微生物种类较多、且丰度高,在未发现生物成因气的地区也存在部分产氢菌与产甲烷菌,但种类相对单一。细菌群落主要以厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)为主,普遍存在的产甲烷菌主要有甲烷囊菌属(Methanoculleus)、甲烷杆菌属(Methanobacterium)、甲烷叶菌属(Methanolobus)。
从表1和表2来看,煤层中分布广泛的细菌群落主要是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes);古菌群落主要以广古菌门(Euryarchaeota)为主。
表1 煤层中已发现的细菌
Table 1 Reported bacterias in CBM fields

细菌类型菌科(属)底物产物盆地/地区文献来源变形菌门SyntrophusRheinheimeraPseudomonasAcinetobacterArcobacterFerribacteriumDesulfofustisDesulfonemaPelobacter长链脂肪酸芳香化合物长链烷烃H2/CO2甲酸乙酸醇类柠檬酸盐H2/CO2萘芳香烃CO2/H2S苯甲酸酯类甲苯碳水化合物H2/CO2乙酸Illinois Basin文献[40]当阳盆地文献[41]粉河盆地文献[42]鄂尔多斯盆地文献[4]鄂尔多斯盆地文献[4]当阳盆地文献[41]Illinois Basin文献[43]Illinois Basin文献[43]鄂尔多斯盆地文献[44]放线菌门GordoniaMycobacteriumRhodococcusBrevundimonas二苯并噻吩对苯基苯酚——沁水盆地文献[34]义马矿区文献[34]Sydney Bsain文献[4]鄂尔多斯盆地文献[4]
续表1

细菌类型菌科(属)底物产物盆地/地区文献来源拟杆菌门BacteroidetesProlixibacterProteiniphilumSediminibacteriumMacellibacteroides糖类碳水化合物挥发性脂肪酸丙酸琥珀酸H2/CO2乙酸H2/CO2蛋白质氨基酸醇类糖类H2/CO2单糖、二糖乙酸、丁酸鄂尔多斯盆地文献[4]焦作矿区文献[34]Bowen Basin文献[34]Sydney Bsain文献[34]鹤壁矿区文献[34]厚壁菌门ClostridiumSporomusaAcidoaminococcusRuminococcusTissierella淀粉纤维素几丁质木聚糖含甲基芳香化合物氨基酸单糖CO2甲醇甲酸CO2/H2S粉河盆地文献[45]Sydney Bsain文献[42]日本北海道文献[3]Illinois Basin文献[43]鹤壁矿区文献[34]
1.2 产气机制
目前,普遍采用微生物降解复杂有机物产甲烷的代谢模型来解释煤的生物降解产甲烷。即,复杂有机物(煤)中的聚合物或单体化合物首先被发酵、分解为脂肪酸、有机酸、醇类等化合物;然后这些中间代谢产物被进一步降解,形成产甲烷菌所需的底物,如二氧化碳、氢气和乙酸等简单化合物;最后在产甲烷菌的作用下产生甲烷(图2)。

图2 煤厌氧发酵产甲烷的生成机制
Fig.2 Mechanism of coal conversion to biomethane
表2 煤层中已发现的产甲烷菌
Table 2 Reported methanogens in CBM fields

产甲烷菌类型底物产甲烷菌盆地/地区文献来源氢营养型H2/CO2MethanoculleusMethaobacteriumMethanocorpusculuMethanobacterialesMethanothermococcusMethanothermobacter日本北海道文献[3]Gippsland盆地文献[14]粉河盆地文献[46]临汾矿区文献 [34]印度某煤矿文献[47]粉河盆地文献[36]日本北海道文献[3]沁水盆地文献[34]淮北煤田文献[34]伊利诺伊盆地文献[48]Waikato煤田文献[37]Alberta盆地文献[38]粉河盆地文献[36]印度某煤矿文献[47]义马矿区文献[34]沁水盆地文献[34]胜利煤田文献[34]乙酸营养型乙酸H2/CO2MethanorixMethanococcusMethanosaetaMethanobrevibacterMethanomicrobiumMethanolinea义马矿区文献[34]鹤壁矿区文献[34]胜利煤田文献[34]焦作矿区文献[34]粉河盆地文献[36]鄂尔多斯盆地文献[15]湖北宜昌某煤矿文献[49]粉河盆地文献[36]义马某矿文献[34]鹤壁矿区文献[34]平顶山矿区文献[34]临汾矿区文献[34]粉河盆地文献[36]印度某煤矿文献[47]胜利煤田文献[34]焦作矿区文献[34]甲基营养型甲胺甲酸甲醇MethanomethylovoransMethanolobus鹤壁矿区文献[34]淮北煤田文献[34]日本北海道文献[3]鄂尔多斯盆地文献[4]Cook Inlet Basin文献[50]粉河盆地文献[46]临汾矿区文献[34]柳林矿区文献[34]胜利煤田文献[34]多种营养型乙酸甲酸甲胺甲醇MethanosarcinalesMethanosarcinaWaikato煤田文献[37]Alberta盆地文献[38]日本北海道文献[3]湖北宜昌某煤矿文献[49]鄂尔多斯盆地文献[4]粉河盆地文献[9]义马矿区文献[34]沁水盆地文献[34]胜利煤田文献[34]焦作矿区文献[34]平顶山矿区文献[34]
基于此,一般采用高通量测序技术、气质联用法(GC-MS)、紫外分光光度法对煤厌氧发酵产甲烷过程微生物菌群特征、液相产物、酶活性等进行测试,并从发酵产气4个阶段揭示生物甲烷生成机制。
1.2.1 水解阶段
水解菌群是发酵能够进行的前提,而且水解阶段的效率直接影响整个发酵系统的运行。这些菌群能够通过释放胞外水解酶将高分子聚合物、芳香化合物等复杂有机物水解成可被微生物利用的简单有机物,为下一阶段微生物代谢提供底物。碳水化合物的水解是通过微生物胞外酶的作用水解成单糖。脂肪在脂肪酶的催化下水解成甘油和脂肪酸,脂肪酸在厌氧条件下较难降解,从而容易积累。在蛋白质水解酶的催化下,蛋白质水解使分子中的肽键断裂,生成各种氨基酸。
生物沼气池或煤厌氧发酵系统中常见的水解菌群主要包括:Acinetobacter,Lysinibacillus,Pseudomonas,Bacillus,Commonas,Exiguobacterium,Sedimentibacter,Sporotomaculum,Proteiniborus,Proteiniphilum。其中能够降解烃类和多种芳香化合物的菌属有:Tissierella,Acinetobacter,Sedimentibacter[51-53]。Bacillus能够产生一种脂肽型的生物表面活性剂,能够增强纤维素酶的热稳定性,促进大分子物质的水解[54];Pseudomonas是一种降解能力极强的菌属,对短链及长链烷烃、芳烃均有降解能力,同时也能参与碳水化合物的发酵[55-56]。Proteiniborus和Proteiniphilum能够水解蛋白质和脂类物质[57-58]。在发酵初始阶段,各类蛋白荧光峰(高(低)激发波长类酪氨酸(类色氨酸)、紫外区类富里氨酸)强度较低,煤表面附着的大量菌群,在适宜的环境条件下能够大量生长繁殖。这些微生物可以分泌胞外聚合物,不仅增加了微生物细胞的体积,同时促进了微生物细胞对煤的吸附作用,从而更容易参与煤的水解,也为后续煤发酵产酸过程的顺利进行奠定了物质基础。在生物发酵的第1~3 d,Acinetobacter,Comamonas,Sedimentibacter的丰度较高(图3),它们能对煤中芳香烃和环烷烃起到降解作用;Sphaerochaeta相对丰度并不高,但是有报道表明该属可降解碳水化合物产生乙醇、乙酸、乳酸、氢气和二氧化碳[59],是煤大分子降解中的主要功能菌属。还有一小部分Proteiniborus,Intestinimonas能够对煤中大分子结构进行降解,变成多环和单环芳烃(PAHs)及其衍生物,并且煤分子结构在空间的排列逐渐变得不规则,芳香环逐步打开,在断开处引入羧基、羟基等含氧基团,形成链状[60]。发酵体系中pH变化不大,化学需氧量(COD)开始呈上升趋势,类色氨酸被分解转化,除少量氮气外基本没有气体产出。而此时的古菌群落中主要以Methnaoculleus和Methanobacterium为主,但是由于没有充足的底物影响了其活性。

图3 不同产气阶段细菌群落在菌属水平的变化
Fig.3 Change of bacteria community on genus level in bioreactors
1.2.2 产酸发酵阶段
在产酸发酵阶段,部分有机化合物氧化后产生的电子,传递给另外一部分有机物,水解阶段产生的可溶性小分子物质被微生物吸收进一步转化为简单的有机物(挥发性脂肪酸、氢气、二氧化碳、醇类等)。这些物质迅速水解产酸产氢,而产甲烷菌数量增殖相对缓慢,不能及时完全利用产生的氢气,所以气相中有氢气的积累并且被检测出。参与这一阶段的菌属主要包括Clostridium,Macellibacteroides,Tissierella,Petrimonas,Anaerovorax,Terrisporobacter。产酸菌Macellibacteroides是该阶段的优势菌种,能够把第一阶段产生的大分子可溶性有机质类物质如短链纤维素进行发酵,产生丙酮酸,并且发生延胡索酸反应,从而产生小分子乙酸、丙酸和丁酸等脂肪酸[61]。Petrimonas是一种能够利用多种碳源的菌,以元素硫和硝酸根作为电子受体,产物为硫化物和氨[62]。Anaerovorax能够利用乙酸、丁酸、氢气和氨气发酵,也能够利用4-氨基丁酸和4-羟基丁酸作为生长基质[63]。Terrisporobacter利用多种糖类产乙酸和二氧化碳,同时也能利用亚硫酸盐作为电子受体释放硫化氢[64]。这也是在发酵前期检测出硫化氢的原因之一。此外,由于地杆菌属Geobacter能够互营氧化乙酸和乙醇,Desulfosporosinus和Desulfitobacterium具有发酵有机物的能力可以分解丙酸、苯甲酸、乙醇和芳香族化合物[65],发生了较多的种间电子转移过程,导致此阶段的二氧化碳与氮气快速产出。由于产甲烷繁殖一代的时间相对较长,在此过程中酸性物质与煤中碳源被其有效利用,总有机碳含量迅速下降,辅酶F420活性增长迅速,并达到最大活性值。
此外在发酵产酸阶段烃类物质代谢较为频繁,主要是直链和支链烃类的分解、利用与再分解的过程较为显著。因为烃类是较容易被微生物利用的物质,其键能相对较弱,在利用酸类物质的过程中,主要产出小分子酸为丁酸。直链烷烃发生延胡索酸加成反应或者羧化反应并进一步合成脂肪酸,随后通过一系列反应转化为丙酮酸[66]。而单一侧链烷烃和喹啉类物质则向其他物质进行转化。同时,糖类也通过酵解途径(EMP)转化为丙酮酸[67]。一方面,丙酮酸继续在丙酮酸铁氧还蛋白酶的作用下发生脱羧反应,羟乙基结合到酶的焦磷酸硫胺素上生成乙酰CoA,同时放出氢气和二氧化碳,而乙酰辅酶A与NADH结合生成乙酸、丁酸等物质。另一方面,丙酮酸在相关生物酶的作用下,其进一步转化为α-乙酰乳酸、3-羟基-2-丁酮,最终生成2,3-丁二醇[68]。这一转化结果使得糖类和烷烃类物质产量降低,丙酮酸和喹啉类产量先增加后降低。煤在微生物作用下,含有的腐植酸物质被转移到液相,HC![]() 呈下降趋势,C
呈下降趋势,C![]() 开始被检出,且含量较高。该阶段可能发生的生化反应主要有:
开始被检出,且含量较高。该阶段可能发生的生化反应主要有:
2C3H6O3+2H2O→CH3CH2CH2COOH+2H2+3H++2HC![]() +2H2 ΔG=-56.2 kJ/mol
+2H2 ΔG=-56.2 kJ/mol
(1)
3C3H6O3→2CH3CH2COOH+CH3COOH+HC![]() +H+
+H+
ΔG=-164.8 kJ/mol
(2)
1.2.3 产氢产乙酸阶段
产氢产乙酸菌是厌氧降解过程中重要的类群,在营养生态位上位于产酸发酵菌群和产甲烷菌群之间,在功能生态位上起到承上启下的作用[69]。但是也有部分产酸发酵菌群同样具有产氢产乙酸的功能,能将产酸发酵菌群产生的丙酸、丁酸等挥发性有机酸(VFAs)和乙醇等进一步降解为乙酸、二氧化碳和氢气,为后续的产甲烷菌提供直接利用的底物[69]。混合样品中属于互养菌门中的微生物分别有胺小杆菌属Aminobacterium、产氢产乙酸菌属Sedimentibacter、脱硫代硫酸盐弧菌属Dethiosulfovibrio和Synergistaceae,它们是厌氧系统中重要的氨基酸降解和产氢产乙酸的功能细菌[70-73],该类微生物在连接发酵型细菌和产甲烷菌中起重要作用。
在这个阶段由于底物的充足,菌群丰度较高,优势菌群为Proteiniborus,Enterobacter。另外,脱硫杆菌Desulfitobacterium利用溶液中的乙酸和![]() 发生还原反应,主要产物是HS-[65]。而Methanobacterium属于氢营养型甲烷菌,介于其对底物利用的局限性,导致该阶段甲烷产率并不明显。此外该阶段有大量的酸性物质生成,芳环上取代基脂肪链被不断分解,降解成羟基、羰基和酯类,同时又有脂肪链物质被分解产生[48];另一方面,乙偶姻、2,3-丁二醇又被缓慢异化生成2,3-丁二酮,最终生成乙酸[74],这是该阶段乙酸缓慢增加的2个根本原因。该阶段可能发生的生化反应主要有:
发生还原反应,主要产物是HS-[65]。而Methanobacterium属于氢营养型甲烷菌,介于其对底物利用的局限性,导致该阶段甲烷产率并不明显。此外该阶段有大量的酸性物质生成,芳环上取代基脂肪链被不断分解,降解成羟基、羰基和酯类,同时又有脂肪链物质被分解产生[48];另一方面,乙偶姻、2,3-丁二醇又被缓慢异化生成2,3-丁二酮,最终生成乙酸[74],这是该阶段乙酸缓慢增加的2个根本原因。该阶段可能发生的生化反应主要有:
CH3CH2CH2COOH+2H2O→2CH3COOH+2H2+H+ ΔG=+48.1 kJ/mol
(3)
C7H6O2+6H2O→3CH3COOH+2H2+H++CO2
ΔG=+53.0 kJ/mol
(4)
C4H6O4+4H2O→CH3COOH+3H2+H++3HC![]()
ΔG=+56.1 kJ/mol
(5)
H2O ΔG=+7.0 kJ/mol
(6)
CH3CH2OH+H2O→CH3COOH+2H2+H+
ΔG=+9.6 kJ/mol
(7)
CH3CH2COOH+3H2O→CH3COOH+3H2+H++HC![]()
ΔG=+76.1 kJ/mol
(8)
1.2.4 产甲烷阶段
1974年,Bryant首次提出了产甲烷菌这一概念[75]。2001年,《伯杰氏系统细菌学手册》将产甲烷菌放在广古菌门(Euryarchaeota)中。产甲烷菌在地球碳循环中扮演着重要角色,是有机物厌氧降解的末端功能类群,能够将有机碳转化为甲烷。它广泛存在于各种厌氧环境中,如海水沉积物、湖泊沼泽及动物瘤胃、盲肠等自然生态系统环境中;也存在于废水、稻草秸秆、禽畜粪便等非自然生态环境中。产甲烷菌分类形式多样,传统的分类是基于微生物的形态结构、生理生化特性等进行的。鉴于产甲烷菌生长条件苛刻,生长速率一般较低,生物量也较少,培养方法特别,其所能利用的底物种类较少,且染色、形态特征也比细菌易变和难确定,给传统分类法带来极大的挑战[76]。迄今为止,仅有200多种产甲烷菌被分离鉴定出来,归属于3纲5目10科29个属。其中5目分别为甲烷杆菌目(Methanobacteriales)、甲烷球菌目(Methanococcales)、甲烷微菌目(Methanomicrobiales)、甲烷八叠球菌目(Methanosarcinales)、甲烷火菌目(Methanopyrales)[77]。随着Hungate厌氧操作技术的发展,对于产甲烷菌的研究越来越多,在不同的生态环境下,产甲烷菌落存在明显差异,其代谢过程也随着环境的不同而体现出多样性。
产甲烷阶段是厌氧发酵的最后一个环节,生理代谢明显区别于其他菌群。产甲烷菌细胞能够形成钠离子或质子跨膜梯度,驱动细胞膜上的ATP合成酶将ADP转化成ATP以获得能量,并通过利用细胞内一系列特殊的酶和辅酶将二氧化碳或甲基化合物中的甲基转化生成甲烷[78]。参与该过程辅酶F420的活性因发酵体系内碳源的减少及过酸性物质的积累而降低至最小值。根据底物类型的不同,可以将该过程分为3类:氢营养型、乙酸营养型和甲基营养型[79-81]。其中,氢营养型途径是以氢气或甲酸作为主要的电子供体还原二氧化碳产生甲烷,并涉及到电子歧化途径,例如甲烷短杆菌(Methanobrevibacter);乙酸营养型是乙酸被裂解产生甲基基团和羧基基团,羧基被氧化生成氢气作为电子供体用于还原甲基基团生成甲烷,如甲烷丝菌属(Methanosaeta);甲基营养途径是以简单甲基化合物作为底物,以外界提供或氧化甲基化合物自身产生的还原当量作为电子供体还原甲基化合物中的甲基基团生成甲烷,如甲烷球菌属(Methanococcus)[82]。通过这3种途径产甲烷的过程中,每消耗1 mol底物所产生ATP的顺序为:氢营养型>甲基营养型>乙酸营养型[78]。
在此发酵阶段,氢营养型产甲烷菌可以利用氢气还原二氧化碳生成甲烷;乙酸营养型产甲烷菌主要以乙酸为发酵底物生成甲烷;甲基营养型产甲烷菌具有细胞色素和一个质子移位电子传输链,能够主要利用甲酸、甲醇、甲胺类物质为底物进行厌氧发酵产甲烷。进入产甲烷高峰期后,群落中甲烷微球目的甲烷卵圆形菌属(Methanocalculus,80.28%)占据绝对优势,热原体目某属(Thermoplasmatales_norank,10.58%)其次。另外,甲烷八叠球菌目的甲烷八叠球菌属(Methanosarcina)和嗜甲基产甲烷菌属(Methanomethylovorans)分别占2.83%和0.74%。甲烷杆菌属(Methanobacterium)和甲烷囊菌属(Methanoculleus)丰度明显减少,甲烷八叠球菌属(Methanosarcina)数量迅速增加并占据主导地位,而体系间的反应热出现下降趋势,降为初始反应热的2.05%。同时,相对活跃的微生物菌群使得煤结构中直链、支链烷烃及苯酚类物质脱落进入发酵液,使得发酵液COD增大。甲酚上甲基发生羟基化反应生成对羟基苯甲醇或者对甲基苯甲醛,并进一步转化为对羟基苯甲酸和苯酚[83];乙苯首先被氧化为1-苯乙醇,并进一步氧化为芳香酮苯乙酮,在苯甲酰乙酰酶A的作用下苯乙酮通过羧化反应生成苯甲酰乙酸乙酯[84]。这一转化特征使得直链、支链烷烃、甲醇类、甲氧基乙酸、辛酯五氟丙酸、非癸酯等有机物含量增加,苯酚类、乙酮类含量降低,并生成三氯乙酸、十六烷基酯、4-溴苯甲醛、三氟乙酰基-鲸蜡烷、2,6,10,15-四甲基十七烷等新生有机物。在产甲烷后期,虽然还是Methanosarcina与Pseudomonas占优势,但此时二氧化碳浓度降低、乙酸浓度突然升高,原因在于Methanosarcina既可以进行乙酸营养型产甲烷,又可以进行氢营养型产甲烷,此时的Methanosarcina改变生理特性,由乙酸营养型变为氢营养型(图4)。该时期内,直链烷烃在生物酶作用下发生延胡索酸加成反应或羧化反应进一步合成脂肪酸,随后转化为丙酮酸[85],导致烷烃类有机物相对含量减少,且1,2,5-二氮唑-3-羧酸开始生成并逐步开始积累,使pH有所降低。二甲胺、N,N-二甲基乙酰胺、N,2,3-三甲基-丁烯酰胺等酰胺类物质可能是由含氮氨基侧链与有机酸或者直链烷烃结合生成,酰胺类水解生成NH![]() 或者氨,在经厌氧氨氧化菌所分泌的联氨脱氢酶作用下产生氮气[86]。3种成因类型的生化反应如下:
或者氨,在经厌氧氨氧化菌所分泌的联氨脱氢酶作用下产生氮气[86]。3种成因类型的生化反应如下:
1)氢营养型。
4H2+O2→CH2+2H2O ΔG=-135 kJ/mol
(9)
4HCOOH→CH4→+3O2+2H2O ΔG=-130 kJ/mol
(10)
4O+2H2O→CH4+3CO2 ΔG=-196 kJ/mol
(11)
CO2(g)+H2O(l)→HCO3-(l)
(12)
2CH3CH2OH(l)+HC![]() (l)→2CH3COO-(l)+H+(l)+CH4(g)+H2O(l)
(l)→2CH3COO-(l)+H+(l)+CH4(g)+H2O(l)
(13)
2)甲基营养型。
4CH3OH→3CH4+CO2+2H2O ΔG=-105 kJ/mol
(14)
CH3OH+H2→CH4+H2O ΔG=-113 kJ/mol
(15)
2(CH3)2S+2H2O→3CH4+CO2+2H2S
ΔG=-49 kJ/mol
(16)
4CH3NH2+2H2O→3CH4+CO2+4NH3
ΔG=-75 kJ/mol
(17)
2(CH3)2NH+2H2O→3CH4+CO2+2NH3
ΔG=-73 kJ/mol
(18)
4(CH3)N+6H2O→9CH4+3CO2+4NH3
ΔG=-74 kJ/mol
(19)
4CH3NH3Cl+2H2O→3CH4+CO2+4NH4Cl
ΔG=-74 kJ/mol
(20)
3)乙酸营养型。
CH3COOH→CH4+CO2 ΔG=-33 kJ/mol
(21)

图4 不同产气阶段古菌群落在菌属水平的变化
Fig.4 Changes of archaea community on genus level in bioreactors
1.3 影响因素
煤在微生物作用下转化形成甲烷、氢气等气体产物是一个多阶段的、复杂的连续性过程,不同的影响因素如煤阶、温度、pH、Eh、微量元素等一方面决定了微生物群落的多样性,另一方面也影响了煤厌氧发酵产甲烷系统的稳定性和效率。
1)煤阶。煤阶对菌群丰度和多样性的影响最显著,一般来说,低阶煤中含植物演化来的、可被菌群利用的氢氧氮物质含量高、营养物质丰富;同时,在煤化作用过程中,有机物生成了大量的湿气和液态烃类,这些物质都为细菌的生命活动奠定了基础,随着煤阶的升高,煤中的含氢氧的侧链逐渐减少,微生物可利用的成分减少[87]。苏现波等[34]发现煤中古菌群落和细菌群落的多样性与丰度在一定程度上随着煤阶的升高呈下降趋势。ROBBINS所做的工作也得出了相同的结论,分析了不同煤阶对微生物的群落影响后发现细菌群落中拟杆菌目(Bacteroidales)的包含的细菌、暗杆菌属(Pelobacter)和古菌群落中产甲烷菌(Methanosaeta)与煤阶存在负相关[88]。
煤阶同样影响着厌氧发酵系统的性能,GUO等[4]以不同煤阶的煤为发酵底物进行了厌氧发酵产气试验,发现随着煤阶的升高甲烷产量有逐渐下降的趋势。同样的结论也被ROBBINS[88]所证实,认为高阶煤中芳香烃含量较高限制了生物甲烷的产出。夏大平等[89]以不同煤阶的煤为发酵底物进行厌氧发酵产氢,发现煤阶较低的长焰煤产气总量为363 mL,贫煤产气总量为30 mL。从这些研究可发现,煤的生物甲烷产量随着煤阶升高而降低。然而,FALLGREN等[90]的研究表明生物甲烷产量与煤阶呈正相关,WAWRIK和HUANG等[91-92]则认为生物甲烷产量与煤阶没有明确的相关性,认为煤厌氧发酵生成甲烷过程中微生物群落和水解阶段的代谢过程是制约生物甲烷产出的重要因素。
2)微量金属元素。微量金属元素作为微生物生长所必需的元素[93],在厌氧代谢过程中能够参与多种关键酶的合成(表3)。有学者研究了厌氧发酵系统中添加微量元素前后微生物的群落变化,发现添加铁、钴、镍后引起细菌群落中拟杆菌门丰度升高,螺旋菌门丰度降低,古菌群落的影响主要表现在甲基营养型的产甲烷菌向乙酸营养型产甲烷菌转变[94]。苏现波等[34]通过煤中微量元素的含量评估煤层原位微生物群落结构时发现铁镍元素对细菌群落的影响大于钴元素,在一定程度上钴元素含量与产甲烷菌的丰度和多样性呈正相关。
表3 铁、钴、镍在厌氧代谢过程中参与反应和转化的酶中的作用[93]
Table 3 Role of Fe,Co and Ni in reaction and transformation in anaerobic metabolism[93]

微量元素功能铁氢化酶、甲烷单加氧酶、一氧化氮还原酶、过氧化物歧化酶、硝酸盐还原酶、固氮酶镍一氧化碳脱氢酶、乙酰辅酶、含甲基还原酶、辅酶F430、脲酶、维持DNA和RNA的稳定、氢化酶钴B12酶、一氧化碳脱氢酶、甲基转移酶
微量元素也对厌氧发酵系统的效率以及稳定性起着重要调控作用[95-96]。MOESTEDT等[97]通过向厌氧发酵系统中添加不同种类的微量元素研究对生物甲烷的促进效应,研究表明微量元素的适当添加可使甲烷产量增加37%,添加不足或浓度过高都会限制甲烷产量。夏大平等[98]发现二价铁离子在较低浓度范围(3倍低浓度)内对生物产气促进作用逐渐增大,而镍离子的添加存在明显的低促高抑现象。
3)温度。温度通过直接影响微生物生长代谢和间接改变微生物代谢环境来影响物种丰度和多样性。现有的研究发现,大多数煤层温度在25~30 ℃,为煤层中微生物多样性提供了比较适宜的温度。其他生境中耐高温的菌群也先后被发现,1991年在深海热泉沉积物中发现一株Methanopyrus能在110 ℃下生长的产甲烷菌[31],2004年从丹麦一处海湾沉积物中分离纯化出45 ℃下生长的产甲烷菌[99]。一般认为,产甲烷菌代谢活动的最适温度在35~45 ℃,随着开采深度的增加,煤层的温度逐渐增高,一些耐高温高压的极端微生物需驯化培育才能满足煤层气生物工程的需求。由于不同地区的菌种有所不同,产甲烷最佳温度区间略有差异。国内学者通过不同温度(10~75 ℃)煤的厌氧发酵初步得出一定范围内生物甲烷产率随温度升高而增大,30~55 ℃范围内甲烷产率较大,同时利于甲烷生成[100-103]。但是对于较窄区间的温度对生物甲烷产出的影响一直没有定论,GREEN等[9]在利用粉河盆地煤层水富集的菌液降解次烟煤的试验过程中,发现当温度从22 ℃升高至38 ℃时,产甲烷速率提高了300%,也有学者认为在25 ℃和35 ℃时甲烷产量最大[104],经过不断的尝试多选取35 ℃作为室内煤厌氧发酵的最适温度[15-17]。
4)pH值。pH作为一种重要的环境因子,不仅能影响微生物酶的活性,而且也影响微生物代谢过程和生理生化特性,因此也对整个微生物群落产生了一定的影响[105]。有学者对不同梯度的pH值环境中的微生物群落进行了调查,发现当pH值从5.5升至6.5过程中,放线菌门(Actinobacteria)成为发酵系统中的优势菌门[105]。另一方面,pH值能够改变细胞膜电荷来影响微生物本身对营养物质的摄入,从而影响底物利用率,因此不同pH值的发酵系统中甲烷生成量变化有着明显区别,有研究者认为,碱性条件下的厌氧发酵系统抑制了产甲烷菌的活性[106]。也有部分学者认为产甲烷最佳pH中偏碱性[107]。苏现波等[108]在进行以低阶煤为发酵底物,不同pH值条件下的产气试验发现pH值在7~8时,低煤阶煤的甲烷生成量达到最大值,随着pH偏向酸性或碱性,甲烷生成量大幅度减少。相同的变化趋势也被Gupta所证实,此外,还发现利用矿井水富集液进行厌氧发酵产甲烷时的最适pH值为7.0~7.5[10],林海等[109]发现最佳产气的pH值为7.0。后续的报道也表明当pH值超出产甲烷菌等微生物的适宜范围时,甲烷生成量极少[110-115]。
5)Eh。氧化还原电位是指微生物生长环境氧化还原情况的宏观体现。氧气、氧化类物质都会引起氧化还原电位的升高,不同微生物对其生长环境的氧化还原电位都有不同要求。反应系统中的Eh值比溶解氧浓度更能准确全面地反映体系的状态。在将氢气和二氧化碳生物转化为甲烷的试验中发现在Eh为-370~-500 mV范围内时甲烷菌生长速率和甲烷产量最佳[116]。在以低煤阶煤为降解底物进行生物模拟产气试验,氧化还原电位在-284 mV时最适合甲烷的生成,此时产气总量和甲烷的浓度最大,得出氧化还原电位是低阶煤生物甲烷化的重要影响因素之一[117-120]。
6)矿化度与地下水动力条件。地下水直接或间接地为煤层中极端微生物的生长代谢提供了物质基础。地下水的径流补给为细菌和古菌群落输送大量有机营养物质,从而使煤层中的微生物群落结构呈现多样性。然而极高的矿化度并不利于细菌生长,矿化度越高,对微生物的抑制性越强,直接影响生物甲烷的产率。有学者在探索盐度对厌氧发酵产甲烷的影响时发现在不添加氯化钠的情况下,低煤阶煤生成的甲烷量最大;随着盐度增高,甲烷生成量逐渐减少,至盐度为25 000 mg/L时,甲烷生成量急剧减少[108];其他学者的研究也表明随着盐度增高,煤厌氧发酵生成的甲烷产量和甲烷浓度也有逐渐下降的趋势[121-127]。
从地下水动力条件看,地下水露头区向深部滞留区的补给是一个缓慢而持续的过程,同时也是把浅部的营养物质逐渐向深部运移的过程。对于地下水补给区而言,严格厌氧的环境难以形成,不利于生物气的生成;滞留区地下水矿化度会增加,有浅部带来的营养物质可能途中被大量利用了,也是不利于生物气生成。只有径流带,既具有厌氧环境,也有丰富的营养物质供给,是生物气生成的最佳场所,这也是粉河盆地目前煤层气开发的重点在盆地的斜坡带的原因之一[128]。
7)煤粒度与比表面积。研究表明当煤中微生物含量高或暴露固体比表面积小时,其有机物的可生物转化率受到制约[129]。煤层中暴露的煤表面积、溶解性、渗透性及微生物量共同制约着煤次生生物气生成速率和生成量。煤粒度的减小与比表面积的增加使得微生物与煤表面充分接触,进而增加对煤的降解强度,且生成较多的生物甲烷。有学者研究证实褐煤的粒径越小,产气量越大[114]。国外学者在研究生物降解次烟煤产甲烷过程中,将煤粒度由1 700 μm减小至106 μm时,甲烷生成率增加了200%[9,129],GUPTA也得出煤的粒径在-60~15 μm甲烷产量最大[10]。
8)显微组分。煤自身的显微组分对生物甲烷的形成具有一定的控制作用,宋金星等[60]以长焰煤与气煤为研究对象,通过评估这2种煤中不同显微组分的产甲烷能力来研究显微组分对生物甲烷代谢的影响,发现镜质组相对于原煤和惰质组,甲烷产量最高,更有利于被微生物降解利用。
9)孔隙空间。微生物的活动需要一定的孔隙空间,致密岩性不利于微生物繁殖,细菌的平均大小为1~10 μm,要求沉积岩的孔隙有3~30 μm以上的空间才能有效地繁殖扩散。因此,对于煤储层而言,煤体结构相对完整的硬煤储层,压裂过程中能够形成支撑裂缝的地区适合于煤层气生物工程的实施;对于渗透性极差,且不可改造的软煤储层,实施煤层气生物工程难以起到增产作用;采空区是最佳的实施场所。
2 煤层气生物工程研究方法
2.1 微生物形态学分析
利用光学显微镜、荧光显微镜可以将分离纯化的菌落做成的薄片,可以观察菌的革兰氏染色效果,菌的大小、形态、菌之间的间隔数、部分生理生化特征,甚至单位面积内的菌数总量。另外,荧光显微镜可以观测到产甲烷菌及产酸菌的荧光特性,这2大类菌种在荧光下会发出蓝绿色荧光,更清楚地观察菌的形貌特征。
2.2 厌氧操作
1)煤层本源菌群的富集、鉴定。新鲜煤样采后立即装入低温厌氧罐及时运往实验室保存备用。将配制好的液体培养基在121 ℃下灭菌30 min,冷却后置于厌氧工作站(DG250)备用。将新鲜煤样取出后破碎成小块,置于液体培养基中,密封后置于煤样采集时的煤层温度条件下恒温震荡培养箱中培养富集20天。为了恢复煤中菌群的活性,按照以下培养基对菌群进行富集培养(1.0 g/L、NH4Cl,0.1 g/L、MgCl2·6H2O,0.4 g/L、K2HPO4·3H2O,0.2 g/L、KH2PO4,酵母膏1 g/L,L-半胱氨酸盐0.5 g/L,0.2 g/L、Na2S,2.0 g/L、NaHCO3,2.0 g/L乙酸钠,0.1 g/L胰蛋白胨),微量元素液:(CoCl2·6H2O,NiCl2·6H2O,MnCl2·4H2O,CuCl2·2H2O,AlCl3·6H2O,ZnCl2,Na2WO4·2H2O,H3BO3,Na2SeO3,Na2MoO4·2H2O);pH=7。
2)培养基优化。培养基包括4个部分:①无机盐:这部分主要含有K、Na、Ca、Mg、P、Cl、NH4+,这些以量级g/L浓度的无机盐对细胞的代谢功能和生命活动至关重要。其中K2HPO4和KH2PO4作为一种常见的缓冲液,能够为微生物对环境的突变提供缓冲。②有机氮:通常添加酵母膏、胰蛋白胨作为有机氮和维生素的来源,而且有研究表明酵母提取物对某些金属阳离子有螯合作用,从而增加了煤的溶解度和生物降解,这些物质的添加量也在g/L级别。③微量元素:主要包括mg/L级别的Mn、Co、Fe、Zn、W、Cu、Se、Mo、B。这些元素能够参与合成产甲烷微生物代谢所需的酶如氢化酶、辅酶F420等。④还原剂。添加L-半胱氨酸盐、Na2S等还原剂是为了创造和维持厌氧还原环境,有助于各类厌氧菌群的生长代谢。
为了降低煤层气生物工程现场实施的成本,同时避免MECBM过程中生成的沉淀堵塞煤层气运移通道,进一步改进和优化培养基显得尤为重要。因此,首先通过多组平行试验在不影响产气量的前提下精确制定培养基的必要成分,排除不必要的成分。然后再对最终确定的物质设置不同梯度的浓度,通过正交试验和响应面曲线法探寻这些物质含量的下限值。
3)高效菌种的筛选与驯化。按照液体培养基组成进行固体培养基配制,放入121 ℃高压灭菌锅20 min,取出培养基,并在超净工作台上向已灭菌的各培养皿中分别倒入20 mL左右的培养基。常温下静置、冷凝形成固体培养基,将消毒灭菌的固体培养基放入已预先开启的厌氧工作站,在厌氧状态下将本源菌接种到固体培养基上,设置多个培养皿作为平行样,并用已灭过菌的涂布棒涂抹均匀。接种完毕后,将培养皿取出,放入厌氧罐内,连接厌氧罐与多功能智能厌氧工作系统,使罐内充满惰性气体(氦气或氩气)用于驱除氧气制造严格的厌氧环境。最后,将厌氧罐放入35 ℃电热恒温培养箱中培养一周。然后在厌氧工作站选择生长状态良好的菌落,使用接种环挑取至新的培养皿,将形状状态相似菌落放入同一培养皿继续培养,以此循环待培养出生长状态良好的菌落进行保留和鉴定。有研究者以风化煤为唯一碳源筛选出了能降解该煤的纯菌株[130],也有学者利用难降解的化合物为碳源和能源筛选出了降解煤化工废水的菌株[131]。
将富集好的本源菌菌液扩大培养,主要原理是降低培养基内可供产甲烷菌直接利用的营养物质(碳源),迫使产甲烷菌利用来自煤的营养物质,提高煤的利用率。进行第1次驯化试验时,将扩大培养基(与富集培养基相同)的碳源浓度降低至3/4,按1∶10的固液比置于已灭菌的空白三角瓶内,15 d为一周期,通过产气数据评估驯化效果。第2次驯化按相同方法,在第1次驯化培养基碳源浓度的基础上继续降低至1/2,以此类推,最终选出能够高效利用煤的产甲烷菌,发现累积甲烷产量大幅提升。未经驯化时,每克煤的累计产甲烷总量4.26 mL,驯化到第5代时,产气量已达到9.26 mL。林海等[109]对污泥中富集菌群驯化后,褐煤产气量提高近30%,产气周期也大幅缩短。也有学者利用逐级传代驯化的方法大幅提升了褐煤的甲烷产气量[132]。
4)菌种的保藏[133]。短期保藏法:在厌氧工作站内,取液体培养菌株中的对数期的菌液1.6~1.8 mL注入2 mL规格螺开菌种保藏管内,置于充满氩气的100 mL或500 mL玻璃瓶内,橡胶塞塞紧管口,从厌氧工作站取出后放入融化的石蜡中,封住瓶口。置于4 ℃的冰箱保存,每隔6个月活化一次,每次活化收集检测甲烷气体,观察生长情况。
长期保藏法:将10 mL 80%的甘油加入0.05 g半胱氨酸颗粒和40 mL的24% Na2S溶液,高温高压灭菌30 min。在厌氧工作站取对数生长后期的产甲烷菌液1.3 mL,注入2 mL规格的螺开菌种保藏管内,加入0.2 mL上述无氧甘油,旋紧管盖,用力摇匀,然后将保藏管置于充满N2的500 mL玻璃瓶内,胶塞密封。从厌氧工作站取出后放入融化的石蜡中封住瓶口置于-86 ℃的超低温冰箱中保藏。18个月活化一次,每次活化收集检测甲烷气体,观察生长情况。
2.3 分子生物学
目前,对生物成因气的微生物学机理的认识还不够深入,沿用生物沼气领域内大分子有机物的降解机理。煤作为一种特殊的有机物,厌氧条件下的生物降解机理以及生物甲烷是否存在其他生成途径需要深入研究。因此,许多学者需要引入基因组学、代谢组学和蛋白组学,有助于深入探讨煤制生物甲烷的代谢机制。
高通量测序技术是目前应用最普遍的新一代测序技术[134-135]。它在分析微生物的群落结构时有着独特的优势,关键在于能够产生测序覆盖深度非常高的16S rRNA 基因的测序数据,用来估计微生物群落的物种构成,能更加真实地揭示原位环境中微生物群落的复杂性和多样性[136-137];同时测序数据还能够给出一定生物统计学信息。维恩图(Veen)、主成分分析法(PCA)等都是用来评估微生物群落结构的主要分析方法。PICRUSt是基于现有的微生物基因组数据库进行比对分析,从而预测和分析样品中功能基因的组成。
宏基因组测序技术在研究中国不同地区的煤层微生物多样性得到了广泛的应用[34]。为了辨别不同煤阶中微生物的OTU的差异,绘制了四维韦恩图(图5)。根据煤阶将煤样分为4组(根据Ro大小从低到高对煤样进行分组),发现古菌群落比细菌群落更易受煤阶影响。

图5 基于OTU的不同煤样中的四维韦恩图和古菌韦恩图[34]
Fig.5 Venn diagram showing number of shared and unique OTU between different groups for baterial and archaea community
主成分分析法(PCA)被用来分析菌群之间的相似性,样本之间的相似度越高,图中的聚合度越高。总体而言,2个轴解释了细菌群落中59%的物种差异性(图6a),古菌群落中2个轴解释了39%的物种差异性(图6b)。PCA分析表明,细菌群落总体上比古菌群落更为分散,这说明细菌群落比古菌群落更容易受区域差异的影响。
为进一步解析微生物构成与基因功能的关系,将基因组序列在数据库Kyoto Encyclopedia of Genes and Genomes(KEGG)进行读取比对,并根据功能分析结果绘制群落结构的基因功能丰度图(图7)。对比细菌群落与古菌群落之间的功能丰度发现在细菌群落,膜运输、细胞运动、外源物质降解能力、能量代谢、和信号传导参与这些代谢的基因功能丰度较高;在古菌群落参与碳水化合物代谢、能量代谢、细胞的复制与修饰相关的基因功能丰度较高。这是由于细菌群落包含各种行使不同发酵功能的菌群,参与的生长代谢比较复杂,对于古菌群落,产甲烷菌代谢相对单一,与细菌群落相比同类型的基因功能丰度较低。

图6 基于OTU的不同煤样中细菌细菌群落和古菌群落的PCA分析[34]
Fig.6 Principal component analysis (PCA) base on OTUs for bacterial community

图7 细菌群落和古菌群落的基因功能丰度
Fig.7 Abundance heat map of gene function prediction in bacteria community and archaea community
蛋白质组学是后基因组时代的热点研究领域。煤厌氧发酵产甲烷的代谢机制是在活性酶的催化作用下进行的,因此产气机制的探讨离不开酶学机制的研究。蛋白质组学的研究在各个领域得到了广泛应用,研究重点已经逐渐从定性研究转移到了定量研究。确定生物体不同状态下的差异表达蛋白质是定量蛋白质组研究的重要方向之一,对理解蛋白质功能以及整个代谢过程起到了重要作用。对于当前产气机制的研究局限在不同产气阶段菌群的演化,并没有理清哪个菌种哪个蛋白结构组成的酶起到了关键催化作用,因此这也是今后需要深入研究的范畴。蛋白质组学和代谢组学可以从系统生物学角度分析酶和代谢物组分,深层次揭示煤制生物甲烷的代谢机制。
2.4 气液固的测试内容和测试方法
2.4.1 气体产量及成分测定
煤厌氧发酵过程中产出的气体是要获得的主要产品,对其成分组成进行检测是最基本的要求,一般采用气相色谱仪对混合气体的组成进行检测。
2.4.2 液相测试技术
1)液相有机物测定,一般采用气相色谱-质谱联用技术来测定挥发性有机物的含量,这种检测是定性、半定量的,要实现精确定量,就必须制作标样。对于一些难以挥发的大分子有机物,如一些糖类、丙酮酸、杂环化合物、多环芳烃、嘧啶类化合物等,则需要采用高效液相色谱-质谱仪进行检测。对于挥发性脂肪酸,可基于外标法,利用气相色谱-质谱联用仪对其进行测定。
2)无机离子测试,厌氧发酵过程的一些无机离子也参与了微生物产甲烷代谢活动,其检测有2种方法,其一是相对渐变的离子色谱法,可用于阴阳离子的测试分析,如![]() 另一种检测方法是化学法,有相关的标准可以依据双指示剂法
另一种检测方法是化学法,有相关的标准可以依据双指示剂法![]() 纳氏试剂法(N
纳氏试剂法(N![]() )、硝酸银法(Cl-)与EDTA容量法(Ca2+、Mg2+)进行检测;③其他液相测试,煤发酵产甲烷过程中的COD质量浓度、辅酶F420活性与反应热可基于重铬酸钾法、紫外可见分光光度法与微量热法进行测试。
)、硝酸银法(Cl-)与EDTA容量法(Ca2+、Mg2+)进行检测;③其他液相测试,煤发酵产甲烷过程中的COD质量浓度、辅酶F420活性与反应热可基于重铬酸钾法、紫外可见分光光度法与微量热法进行测试。
2.4.3 固相测试方法
1)煤的物质组成。在煤的形成过程中,由于成煤环境、温度和压力的不同,导致煤的性质有较大差异,通过工业分析(水分、灰分、挥发分、固定碳、发热量)和元素分析(C、H、O、N、P、S)可大致了解煤的性质。煤的工业分析和元素分析可参照GB/T 212—2001《煤的工业分析方法》与GB 476—91《煤的元素分析方法》标准进行测试。煤显微组分的观测和鉴定参照GB/T 8899—2013《煤的显微组分组和矿物测定方法》,镜质体反射率测试方法参照GB/T 15591—1995《商品煤反射率分布图的判别方法》。
2)煤的结构。X射线衍射(XRD)与拉曼光谱是分析煤结构的常用方法,XRD主要用于物相分析和晶体结构的测定。拉曼光谱是一种无损的分析技术,可以分析煤晶体结构中C—C,C![]() C,N—O,C—H等单一化学键的变化情况,也可以分析基团的振动情况等。
C,N—O,C—H等单一化学键的变化情况,也可以分析基团的振动情况等。
3)煤的形貌观测。一般来说,煤具有复杂的表面结构,特别是在燃烧、液化、气化过程中将发生变化,煤的发酵过程也不例外。可通过光学显微镜观察煤厌氧发酵产甲烷前后显微组分表面的变化。相比于光学显微镜,扫描电子显微镜分辨率更高,可以观测煤表面细菌的形貌、作用前后煤体形貌的变化、新生成的物质等。原子力显微镜(AFM)相对于扫描电子显微镜具有许多优点,利用AFM可对煤发酵产甲烷过程中的微生物细胞的表面形态进行观察,同时也包括对蛋白质、DNA、RNA、核酸与蛋白质复合物等生物大分子结构与性质的研究以及实现对生物分子表面的各种相互作用力的测量。
4)煤的官能团。在有机物分子中,组成化学键或官能团的原子处于不断振动的状态,其振动频率与红外光的振动频率相当。用红外光照射有机物分子时,分子中的化学键或官能团可发生振动吸收,不同的化学键或官能团吸收频率不同,在红外光谱上将处于不同位置,从而可获得分子中含有何种化学键或官能团的信息。采用傅立叶红外光谱仪可对发酵产甲烷过程中的煤官能团结构进行分析。
5)煤的表面元素。X射线光电子能谱(XPS)是一种研究固体材料表面的先进技术,可以对表面元素进行定性定量并提供其价态信息,通过对样品产生的光子能量和化学位移大小的测定,可以了解煤样中元素的组成和状态。
6)煤的孔隙分析。目前煤的孔隙结构测试方法包括气体吸附法(低温氮吸附、低温CO2吸附)、压汞法、显微CT法及小角X射线散射法。其中,氮吸附法和压汞法的原理相对简单,可对孔隙特征进行表征。利用显微CT成像技术能够直接观测到煤岩的孔隙结构、形态以及连通性。压汞、氮吸附法是较为常用的联合测试方法,其中压汞试验的测试范围较广,理论上可以覆盖纳米级和微米级等多个尺度的孔隙;低温氮吸附试验则主要用于测试纳米级孔隙(<50 nm),但无法测试到<2 nm的孔隙,而CO2吸附方法可弥补这一缺陷。小角X射线衍射(SAXS)能够确定煤颗粒内部密闭的微孔,可以得到微区尺寸和形状、非均匀长度等统计参数,同时实现对煤岩内微结构的动态研究。
2.5 增产效果评价
在进行煤层气生物工程试验时,通过向煤层注入营养物质或菌液,以达到增产煤层气的目的,为了查明微生物作用能力和增产效果,可以利用煤层气的同位素地球化学特征变化来判别,具体方法下:
1)原位条件下的厌氧发酵产气试验。采集试验区煤层和煤层水作为试验用的煤、菌、液,通过培养基优化,在储层温度下进行厌氧发酵产甲烷试验。分别测试发酵过程中气固液菌的变化情况,由此确定各阶段甲烷的成因类型,根据甲烷的碳氢同位素建立成因类型判识模板(图8)。

图8 实验室厌氧发酵与自然界不同类型生物成因煤层甲烷碳氢同位素的差异性
Fig.8 Laboratory anaerobic fermentation comparison with template of hydrocarbon isotopes of biogenic coal seam methane of different genesis in nature
2)原始气液菌特征。现场采集试验区煤层气井原始气体,测试气体的成分组成(甲烷、二氧化碳、氮气、氢气、重烃等)和甲烷的碳氢同位素值,查明该地区煤层气的原始地球化学特征,确定其成因类型。对该区煤层气井原始水样进行常规水质分析、水中有机质类型及含量分析、菌群分析。
3)产气过程中气液菌特征。根据产气实际情况,定期或不定期采集气液样品,分别测试气体的成分和甲烷碳氢同位素值、测试液相体系中有机和无机物的成分、测试菌群,由此与原始的气液菌组成对比,判别有没有生物气的生成,是哪一种成因的。最直观的是将甲烷的碳氢同位素测试结果放到图8的模板中,看是否偏离了原来的范围,由此确定生物气的生成情况,在根据气液菌特征确定具体成因类型。可以根据碳氢同位素的变化定量计算生物气的贡献。
B=-26.2lgRo-34.12 (Ro<1.3%)
(22)
B=25.85lgRo-43.08 (Ro≥1.3%)
(23)
C=Ax+B(1-x)
(24)
D=Ay+B(1-y)
(25)
(26)
(27)
(28)
式中:A为生物成因煤层气δ13C1值;B为热成因煤层气δ13C1值[138];C为原始混合成因煤层气δ13C1值;D为微生物增产后煤层气δ13C1值;x为原始条件下生物成因煤层气所占百分比;y为增产后生物成因煤层气所占百分比;Ro为镜质组反射率;y/x为增产评价系数。
3 煤层气生物工程应用前景
煤层气生物工程涵盖了资源、环境和材料三大领域,具有广阔的应用前景,地面和地下工程的实施可实现其多重目标。其中地面发酵池产气工程类似于现有的沼气池或垃圾填埋厌氧发酵工程,地下工程是将营养物质或菌液作为压裂液注入到未采的煤层或采空区,促使煤的厌氧发酵产甲烷。
3.1 多重效应
1)增气。煤层气生物工程实施的首要目的就是增加煤层气井的产量,是通过生成新的煤层气来增加单井控制范围内煤层气的资源量。而且经过驯化的菌群产气效果更好。经过以褐煤为碳源的逐级传代驯化后,累积甲烷产量大幅提升。未经驯化时,每克煤的累计产甲烷总量4.26 mL,驯化到第5代时,产气量已达到9.26 mL(图9)。这说明驯化对提高产气量作用明显,驯化效果较好。同时随着驯化次数的增加,菌种的适应期显著缩短,说明菌群已经可以很好地适应以煤为底物的发酵环境并利用其产气。因此在相对适宜的煤层环境中注入驯化后的微生物菌液,在一定程度上有效提升了甲烷产量,实现煤层气井的增气增产。

图9 褐煤在微生物驯化后甲烷产量的变化
Fig.9 Methane yield of lignite after microbial acclimation
2)增液。煤厌氧发酵产甲烷的同时,也产生了种类繁多的液相有机物,这些副产品通过排采水排出,浓度达到一定程度后可以分离提纯利用。为了探究不同煤阶在微生物作用后的产液潜力,以淮南、鹤壁、赵固煤样为降解底物,对应地区的菌群为菌种来源进行了厌氧发酵模拟试验,并对试验结束后的发酵液进行GC-MS分析。表4中整理了置信水平>90%的化合物。淮南、鹤壁、赵固煤样发酵系统中液相产物总量分别为243.72、198.01、200.11 mg/L,主要由烷烃、芳烃、胺类、酸类、酯类和醚类等物质。烷烃是这3种发酵系统含量最高的有机物,分别为126.03、114.34、122.07 mg/L。淮南发酵系统由于煤阶较低、降解比较充分,有机物种类比较丰富,芳烃总量为19.55 mg/L,胺类物质总量为31.49 mg/L,酯类物质总量为54.08 mg/L。鹤壁发酵系统中剩余以胺类和酯类物质为主,含量分别为31.00、30.07 mg/L;赵固以芳烃、胺类和酯类为主,含量分别为21.82、37.92、23.85 mg/L。另外除在淮南煤样的发酵系统中检测出醚类物质外,其余两发酵系统中均未检测出。这些种类丰富的有机物为化工产品的提纯提供了物质基础。
表4 产气结束后发酵系统中的液相物质
Table 4 Liquid phase chemicals in fermentation system at end of gas generation

分类物质液相物质浓度/(mg·L-1)淮南鹤壁赵固直链烷烃十四烷17.2914.0111.66十八烷8.133.2713.92十九烷6.538.729.83二十烷12.7511.7216.33二十一烷11.1615.6413.78二十六烷——3.71二十四烷11.3913.467.89三十烷4.787.514.95三十一烷7.763.83—三十二烷9.68—12.36支链烷烃4,6-二甲基十二烷4.548.6310.363-甲基三十三烷5.22——11-甲基二十五烷3.82——2-甲基三十二烷3.982.6—4-甲基二十烷5.14——11-甲基二十六烷3.82——3,6-二甲基癸烷5.02——2-甲基二十八烷5.02——2,6,11-三甲基十二烷—7.97—2-甲基辛烷—2.595.833-甲基十七烷—2.77—2-甲基十八烷—3.15—5-甲基十四烷—5.728.363-甲基二十烷——3.0910-甲基二十烷—2.75—胺类物质十四烷胺4.87——3-羟基-N,N-二甲基丙酰胺7.878.7310.67N-(2,2-Dichloro-1-hydroxy-ethyl)-2,2-dimethyl-propionamide9.119.4712.58甲基酰胺4.066.688.02二甲胺5.586.126.65酯类物质Oxalic acid, bis (6-ethyloct-3-yl) ester——5.85Propanoic acid,2,2-dimethyl-,chloromethyl ester8.773.01—Propanoic acid,2-chloro-,pentyl ester8.053.964.56Oxalic acid,6-ethyloct-3-yl heptyl ester11.82——Butanoic acid,3-oxo-,2,2,2-trichloroethyl ester8.78—3.62Imidodicarbonic acid,diethyl ester16.667.16—Acetic acid,chloro-,1-methylbutyl ester—4.674.31Chloroacetic acid,cyclohexyl ester—4.33—Boric acid,ethyl-,didecyl ester—4.09—Methoxyacetic acid,tetradecyl ester—2.85—Chloroacetic acid 3-methylbutyl ester——2.85Ethanedioic acid,bis(1-methylpropyl) ester——2.66芳香化合物甲苯4.655.324.96苯酚5.622.973.463,4-二甲基苯甲醛4.63——2,3-Pyridinedicarboxylic acid—2.98—Glycyl-dl-alanine—2.57—Folic Acid4.653.122.01Fumaramic acid——3.18Phenylphosphoric acid——2.662,3-Pyridinedicarboxylic acid—2.98—Fumaramic acid—2.66—醚类物质Tetraethylene glycol monododecyl ether7.21——Boron trifluoride etherate5.36——
3)增解。为了探究微生物作用前后煤的亲甲烷能力的变化,以250~180 μm(60~80目)淮南和鹤壁的煤粉为发酵底物,以这2个地区富集的本源菌为菌种来源进行厌氧发酵模拟试验,利用ISO-300(Terra Tek USA)等温吸附仪,根据GB/T 19560—2008《煤的高压等温吸附试验方法》标准对产气前后煤样进行等温吸附测试(表5)。试验结束后发现淮南、鹤壁煤样在微生物作用后兰氏体积都有不同程度的降低(图10),2个煤样的兰氏体积分别降低了6.51%和2.62%。这说明经过厌氧发酵后,煤的亲甲烷能力降低,有助于煤层气解吸,实现煤层气井的增解增产。
表5 生物产气前后煤的等温吸附数据
Table 5 Isothermal adsorption data of coal before and after biogas production

样品VL /(cm3·g-1)变化率 /%PL /MPa变化率/%淮南-117.153淮南-216.036-6.511.0961.1676.08鹤壁-126.882鹤壁-226.178-2.621.0971.005-8.38

图10 不同煤样微生物作用前后的等温吸附曲线
Fig.10 Isothermal adsorption curves before and after microbial interaction in different coal samples
4)增透。为了探究微生物能否改善煤储层的渗透率,挑选淮南、鹤壁、赵固3个地区厚度不小于100 mm强度较高不易碎的大块煤样用于钻取规格为ø50 mm×L50 mm煤心,并进行了煤柱的厌氧发酵产气试验,对微生物作用前后的煤心进行渗透率和压汞测试,如图11所示。产气结束后淮南、鹤壁、赵固的煤柱的渗透率都有不同程度的增加,淮南和鹤壁的平均增幅分别为37%和49%,赵固的平均增幅超过了200%(表6)。这说明微生物作用能够有效改善煤储层渗透性。厌氧发酵前后淮南、鹤壁和赵固煤的总孔容和大孔孔容不同程度的增加(表7),说明煤经微生物代谢生气过程中发生部分降解,且主要影响的是大孔隙,这与产甲烷菌的微米级大小是一致的。即微生物作用后裂隙和大孔隙度得以增加,从而提升了储层的渗透率,实现了增透增产。

图11 微生物作用后煤的孔隙与渗透率变化
Fig.11 Change of pore volume and permeability before and after anaerobic fermentation
表6 微生物作用前后煤心的渗透率变化
Table 6 Permeability changes of coal core before and after anaerobic fermentation
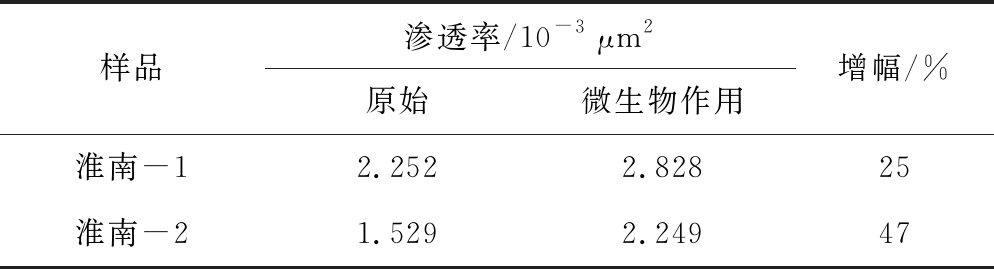
样品渗透率/10-3 μm2原始微生物作用增幅/%淮南-12.2522.82825淮南-21.5292.24947
续表6
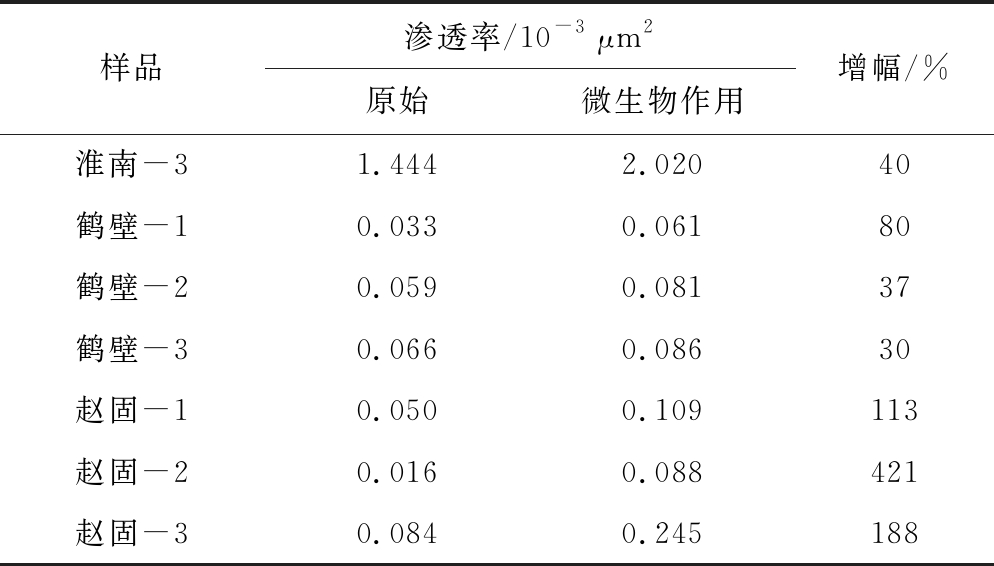
样品渗透率/10-3 μm2原始微生物作用增幅/%淮南-31.4442.02040鹤壁-10.0330.06180鹤壁-20.0590.08137鹤壁-30.0660.08630赵固-10.0500.109113赵固-20.0160.088421赵固-30.0840.245188
5)减排。在以往煤的厌氧发酵产气试验中发现二氧化碳的含量并不高,在试验后期基本上不再生成,一方面由于其在发酵时溶解度较大;另一方面是因为二氧化碳持续被氢营养型的产甲烷菌利用。因此,在生物甲烷产气后期注入一定量的二氧化碳可以使甲烷产率回升。第1个产气周期内,甲烷在整个产气过程中呈先升后降的变化趋势,在第1天产量仅为0.04 mL/g,随后一直持续上升,在第10天达到峰值0.5 mL/g,波动上升一段时间后,在第16天有明显的下降趋势。二氧化碳的变化趋势与甲烷相一致,在第15天降低至0.01 mL/g保持小幅度的波动,第1阶段甲烷累计总产量为5.26 mL/g。在第36天向发酵系统注入200 mL二氧化碳后,甲烷的产量开始逐渐回升,产气周期持续约10 d,累计产甲烷量为1.4 mL/g,二氧化碳持续降低(图12)。试验表明在厌氧发酵系统的产气末期通入一定量的二氧化碳能够实现生物甲烷化,为煤层气生物工程的减排增产提供了试验支撑。
表7 不同煤样的不同孔径占比
Table 7 Ratios of different pore sizes of different coal samples

样品大孔孔体积/(cm3·g-1)比例/%中孔孔体积/(cm3·g-1)比例/%小孔孔体积/(cm3·g-1)比例/%微孔孔体积/(cm3·g-1)比例/%总体积/(cm3·g-1)淮南0.023 450.860.003 06.520.011 023.910.008 618.690.046 0淮南-s0.032 956.720.003 15.340.012 321.550.009 516.720.057 8鹤壁0.033 057.690.002 44.190.011 219.580.010 618.530.057 2鹤壁-s0.037 461.920.002 54.130.010 918.040.009 615.890.060 4赵固0.019 646.880.004 611.000.010 224.400.007 417.700.041 8赵固-s0.034 658.640.002 94.910.011 218.980.010 317.450.059 0
注:微孔(3 nm <孔径<10 nm);小孔(10 nm <孔径<100 nm);中孔(100 nm <孔径<1000 nm);大孔(孔径>1000 nm);原始煤样-s为生物处理后对应的煤样。

图12 二氧化碳生物甲烷化
Fig.12 Microbial transformation of carbon dioxide into biological methanation
6)新材料生成。在煤的厌氧发酵产甲烷过程中,适当加入二氧化碳能够实现生物甲烷化,与此同时二氧化碳以![]() 的形式存在于发酵体系中,通过调节发酵系统中的pH值促进
的形式存在于发酵体系中,通过调节发酵系统中的pH值促进![]() 的电离,并加入氧化钙等含Ca2+的物质,通过探索发酵系统中各项参数及微生物的种类确定纳米方解石的最佳合成方法。
的电离,并加入氧化钙等含Ca2+的物质,通过探索发酵系统中各项参数及微生物的种类确定纳米方解石的最佳合成方法。
(29)
(30)
(31)
在高硫煤在厌氧发酵产甲烷时,伴随一定量的硫化氢产出,在发酵系统中添加含铁化合物、零价铁、纳米铁氧化物等来合成纳米黄铁矿。通过添加物的种类和含量及发酵系统参数的调控,探索纳米黄铁矿的生成途径,不仅实现了硫化氢废气处理,同时生成了纳米材料。
H2S(g)→H+(l)+HS-(l)
(32)
HS-(l)→H+(l)+S2-(l)
(33)
S2-→S-
(34)
2S-+Fe2+→FeS2↓(s)
(35)
7)生物脱硫与硫化氢的成因。高硫煤的脱硫,特别是有机硫的脱硫一直是煤炭清洁利用的一个技术难题,迫不得已在煤炭利用后,对其产生的含硫气体进行处理,如电厂的烟道脱硫,由此产生的脱硫石膏又成了一种固体废弃物。在以往的煤厌氧发酵产甲烷过程中发现,不仅生成了甲烷、二氧化碳和氮气,同时也生成了一定量的硫化氢,由于含量较低没有引起足够的重视。为了探讨生物硫化氢的成因,以不含硫的培养基富集本源菌群,并且对比了不同培养基中的微生物群落结构(图13)。在含硫的培养基中发现了6种硫酸盐还原菌(SRB)分别是:Desulfovibrio、Desulfosporosinus、Desulfitibacter、Desulfotomaculum、Desulfitobacterium和Desulfomicrobium;在不含硫的培养基中仅以高硫煤为硫源,令人意外的是仍有SRB的存在,但仅有Desulfovibrio。随后利用不含硫的培养基进行高硫煤的厌氧发酵产气试验,产气过程生成了大量的硫化氢气体。在产气进行第3天时生成的硫化氢达到峰值363×10-6,随后持续下降并在产甲烷高峰到来之前降至最低点;在第15天左右硫化氢的浓度又开始呈上升趋势(图14)。硫化氢一般是硫酸盐还原菌(SRB)的代谢产物,但发酵系统中除高硫煤外,不含任何含硫物质,于是在这个试验基础上提出一系列的科学问题:SRB是否参与了非硫酸盐还原途径产硫化氢的生成,硫化氢还有哪些成因?各种成因的优势菌群有哪些?代谢机理是什么?

图13 基于菌属水平不同培养基富集的微生物分类
Fig.13 Bacterial community structure in different medias
通过对试验过程中的硫化氢浓度变化规律、煤中有机硫含量的降低、液相物质检测出的硫醇硫醚,初步认为厌氧发酵系统中硫化氢的成因分为2个阶段:水解产酸发酵阶段含硫氨基酸的脱硫作用,产甲烷阶段甲基营养型产甲烷菌的作用。
含硫氨基酸(半胱氨酸)→NH3+H2S+有机酸(乙酸)
(36)
(37)
对于发酵系统中不同阶段哪些关键菌群所起的作用、SRB是否参与非硫酸盐还原途径、有机硫在此过程中扮演的角色等并不清晰,需要进一步探索,但可以肯定的是厌氧还原条件下可以实现高硫煤有机硫脱除的。因此这也构建了煤层生物硫化氢成因机制与高硫煤脱除的研究框架:以不同地区、不同时代、不同煤阶的高硫煤为研究对象,以这些煤或同源煤层水中的本源菌群为菌种源,通过分析煤厌氧发酵过程中气固液菌的变化,以产甲烷量最大化为目标,查明此过程中形态硫的转化规律以及硫化氢的生成条件和成因类型,揭示其生成机制。

图14 高硫煤在厌氧发酵过程中的产气变化趋势
Fig.14 Gas production trend of high sulfur coal in anaerobic fermentation process
3.2 地面发酵池产气工程
地面发酵池产气工程可建设专门的发酵设施,也可利用山沟、洼地等地形优势,做防渗处理后作为发酵场所,这与垃圾填埋发酵产气—发电工程类似。无论是哪一种设施,都要能够回收气相和液相物质、便于下一步煤的加工利用。地面发酵池工程主要结合褐煤的提质和高有机硫煤的脱硫实施的,附带合成一些新产品。褐煤资源丰富而且是相对其他煤阶煤最易被微生物降解的,因此是产甲烷菌的最佳煤种。生成的生物甲烷经提纯除杂后被利用,伴生的液相产物是重要的化工原料,经化学提纯后被利用。另一方面,褐煤本身因水分高而热值低,在运输、利用前往往需要进行干燥脱水处理,首先将其部分转化为清洁的甲烷和类石油产品,降低了煤中水分含量、提高了碳含量、增加了热值,从而提高了煤炭质量;同时,产气后的残煤可以加工成煤基木炭,形成高热值、洁净环保的燃料,实现了褐煤的加工升值。为了增加产气效果和后期煤基木炭的生产,可在褐煤中添加一定量的生物质,实现褐煤与生物质的联合厌氧发酵(图15)。
高硫煤中有机硫的脱除一直是难点,不得不采用后处理手段,在煤被利用后处理其生成的含硫气体,如电厂的烟道脱硫。如前所述,高有机硫煤在厌氧发酵产甲烷过程中,有机硫是可以在细菌的作用下转化为硫化氢被脱除的,生成的硫化氢的脱出相对容易,且可以资源化的。
在材料合成方面,一部分液相产物可以作为合成新型化工产品的原材料。另外,在发酵的后期,首先通入一定量的二氧化碳,为氢营养型产甲烷菌提供底物,将部分二氧化碳还原为甲烷,实现温室气体减排;待这一产气工程基本结束后,同时注入二氧化碳和含钙离子的溶液,并调整pH为碱性,在合理控制生成条件下合成纳米方解石,这是一种用途广泛的新材料,在后期的残煤深加工过程中通过洗选回收该产品。对于高硫煤的厌氧发酵系统,除了实现上述二氧化碳减排和矿化以外,发酵过程中生成的硫化氢的利用可分为2个阶段—生成阶段和生成后阶段。硫化氢在厌氧发酵生成阶段,就向煤中添加含铁化合物、纳米金属,使之与铁结合生成纳米黄铁矿,实现硫化氢的即生即转、不再排出。对于生成的硫化氢,采用弱碱溶液从气体中脱出后,将溶解态的硫化氢合成为纳米黄铁矿,实现其资源化。纳米黄铁矿是太阳能电池领域的重要材料。

图15 地面煤层气生物工程
Fig.15 Coalbed Gas BioEngineering in ground
3.3 地下煤层气生物工程
根据地下煤层气生物工程实施的场所,可区分为未采区原始状态下的煤层和采空区残煤。对于未采区的煤层气生物工程可以有2种实施方式:
1)将以营养液为主的压裂液注入煤层激活煤层本源微生物进行生物代谢产甲烷,实现了煤层气的增产。这一技术适合于一些有法律限制的国家和地区,一些国家是不允许外来微生物注入的。
2)将驯化后的微生物菌液作为生物压裂液注入煤层。这2种方式实施过程中都可以伴注二氧化碳,增加氢营养型甲烷菌作用下甲烷的生成量。工程实施采用的井型多样化,目前的煤层气井型都可以实施,如直井、丛式井和水平井;每种井型可作为独立的生产系统运行,也可以多井联合运作,即一口井作为注入井,周边数口井作为产出井。井身结构的选取可根据煤层地质条件与经济成本进行选择。这种工程实施与常规煤层气工程相比唯一的差别就是将过去的普通压裂液改为生物压裂液,而伴注二氧化碳也是一种成熟技术。因此,在工程实施上没有难度的,且通过合理优化培养基菌液,其成本不会高出原来的压裂液,经济上也具备技术可行性(图16)。
中国煤矿采空区分布十分广泛,由于采煤工艺和地质条件的限制,煤炭回采率一般不超过50%;同时还有附近的一些薄煤层、沉积岩中的分散有机质等,也就是说,采空区及其上下围岩中可能还有一层原始煤的有机质可以被利用,微生物代谢的底物丰富。采空区煤层气生物工程的可操作性和适用性最为广泛:首先采空区的冒落带、裂隙带有大量的自由空间,渗透性非常好,利于菌液的注入和扩散,为微生物的活动提供了更大的空间;其次采空区是一个理想的厌氧发酵场所,为厌氧微生物生长代谢提供了相对适宜的还原环境;最后,不需要压裂,直接向采空区灌入菌液和二氧化碳即可。在菌液注入后,观测动态产气情况,一旦产气,就采用负压抽采。产气的后期再注入一定量的二氧化碳和含钙离子的物质,二氧化碳和采空区积水中的钙离子、以及注入的钙离子结合生成方解石,对采空区起到固化作用,防止地面沉降;同时又实现了二氧化碳的矿化埋存,具有改善生态环境和大气环境双重意义。
无论是未采区还是采空区煤层气生物工程,注入的二氧化碳除了具有上述功能外,还有一种置换甲烷产出的作用。利用煤的亲二氧化碳能力强于甲烷、利用分压分体积原理,都会增加煤吸附二氧化碳的量,驱使甲烷解吸产出。另外,二氧化碳是以液态注入的,到地下后气化时的体积膨胀,将会产生微裂缝增加煤储层的渗透率。

图16 井下煤层气生物工程
Fig.16 Underground coalbed gas bioengineering
4 煤层气生物工程发展趋势
煤层气生物工程一经诞生就以其强有力的生命力在飞速发展,然而,必定是一个全新的研究领域,涉及到资源、环境、材料三大领域和多个学科,还有大量的科学问题和技术难题需要解决,主要表现在以下6个方面。
4.1 高效产甲烷菌群的培育
目前实验室采用常规的培养基,在最佳的温度下进行的厌氧发酵产气试验,对于产气机理的探讨是有益的,但不能满足煤层气生物工程现场实施的需求。培养基中的各种营养物质的优化和工程实施没有难度,难题主要在产甲烷菌上。产甲烷菌活动的最佳温度是35~45 ℃,而我国目前煤层气开发比较活跃的地区的储层温度一般不超过30 ℃,产甲烷菌在这一储层温度下代谢能力急剧下降,产气效果变差。因此,要做到煤层气生物工程的普适性,就必须培育低温、高效产甲烷菌种,这是首要任务。
4.2 煤降解率的提升
产甲烷菌充足的底物来自于水解阶段煤的降解,降解率越高,底物就越丰富,越利于产甲烷。以往人们采用了很多方法,如强酸、强碱、真菌等来预处理煤,取得了一定的效果,但这些方法在现场实施存在难度。采用强酸、强碱处理,会造成储层的酸敏、碱敏伤害,还会使得储层的pH变化,严重影响产甲烷菌的代谢。白腐菌处理更不可取,其繁殖会严重堵塞裂缝,造成储层伤害。近期关于二氧化碳萃取对煤结构的影响以及对生物甲烷生成的影响的研究取得了可喜的进展,即那些处于超临界环境的煤储层,注入的二氧化碳对煤的萃取作用,加大了煤的降解,同时改变了煤的表面结构,促使生物降解的进行,将是促使生物煤层气增产的有效途径之一。但是,毕竟处于超临界状态的煤储层,在目前的煤层气开发范围内,这种温压条件还是不多见的,对于深部高温高压下的储层肯定是一种有效的途径。因此,必须加强水解阶段的研究,培育出降解能力强的水解菌种是迫切需要解决的问题。同时,还要探索其他能够实施的、有效增加煤原地“液化”量的、且不影响产甲烷菌群活动的方法。
4.3 微生物代谢生理生化机制分析
目前煤层气生物工程领域的微生物学研究基本上借鉴了沼气领域的理论和方法,煤在微生物的作用下是否和生物质的产甲烷过程相同,是否严格按照4个阶段进行,都有待探讨。从目前的研究看,有其相同的部分,也有不同的一面。但是,对于煤厌氧发酵产甲烷过程中微生物代谢的生理生化机制的探讨基本上还没有起步,这是最根本的问题,这一问题不解决,其他都无据可依。因此,迫切需要借助各方力量,尽快开展蛋白组学和代谢组学领域的研究。
4.4 工程试验的必要性
目前的实验室对产气条件的研究、培养基的优化、菌种的驯化等,都有了比较明确的认识,要使这一领域的研究更进一步,就要进行工程试验,从试验中发现问题解决问题,从而使得这一学科逐渐完善。澳大利亚现在正在进行一系列的试验,预计未来2~3年内会有突破性进展。为了保持我国在这一领域的领先地位,迫切需要进行现场工程试验。合理优选出最佳的采空区和未采区,进行工程试验,是促使这一领域发展的关键。
4.5 煤炭微生物脱硫
以往的煤炭微生物脱硫多采用氧化硫铁杆菌将硫铁矿类的硫化物氧化为硫酸盐硫,达到脱硫目的。这一技术脱除的是无机硫,且是在氧化环境下进行的,对于有机硫目前物理的、生物的还没有有效的办法,化学的成本高、严重影响煤质。在进行高硫煤厌氧发酵产甲烷试验时,发现生成了一定量的硫化氢,但又非已知的硫酸盐还原成因,其潜在的生成机制还需要深入探讨。这将是一种煤中有机硫有效脱除的新途径,其潜在效益显著,是一个极具价值的探索领域。
4.6 新材料合成
新材料合成是煤层气生物工程的一个延伸领域。其中的褐煤提质与煤基活性炭的制作是一个具有潜在工业价值的领域,最近笔者已经初步完成了实验室工作。采空区注二氧化碳,实现其矿化埋存,达到固化采空区的目的,从技术上没有难度,是可以实施的。纳米黄铁矿和方解石的微生物生成机理要进行深入研究,低成本、高效的合成工艺要进一步探索。这一技术的突破将为温室气体减排、煤炭洁净利用提供创新性技术。另外,可进一步延伸到脱硫石膏的黄铁矿化,即利用硫酸盐还原菌将石膏还原为硫化氢,硫化氢合成纳米黄铁矿。
5 结 语
微生物强化煤层气产出(MECBM)经过10余年的发展,成为现今具有自身的理论体系、方法体系和实用性的一门新兴边缘学科——煤层气生物工程,正以其潜在的优势飞速发展。煤厌氧发酵的影响因素和甲烷的生成机制基本查明,为煤层气生物工程的实施奠定了理论基础;该学科的研究方法基本形成,特别是增产效果评价方法的建立,为工程实施提供了强有力支撑;现行的经济技术条件下无论是地面还是井下煤层气生物工程的实施都是可行的。
中国煤层气勘探开发历经40年,除了个别省份实现了商业化运作外,大部分省份还处于艰难的探索中,已经施工的18 000口左右的煤层气井中,只有1/3实现了商业达产,寻求新的增产技术是当务之急。煤层气生物工程的诞生无疑为中国煤层气井增产提供了一条新途径,除了增气、增解、增透实现煤层气井的增产外,注入的二氧化碳被微生物还原为甲烷、二氧化碳与甲烷的竞争吸附对甲烷的驱替,也有利于增产;采空区煤层气生物工程的实施,实现了生物采残煤和二氧化碳的甲烷化与矿化,可见这一工程实施的环境效益显著。还可以延伸到煤炭脱硫、纳米黄铁矿和方解石的微生物合成等领域。
煤层气生物工程是一个全新的研究领域,还有大量的科学问题需要解决、技术难题需要攻关。本文仅对现阶段这一领域的研究现状进行了系统的总结,初步厘定了这一学科的内涵和外延,并对下一步迫切需要研究的问题进行了展望,抛砖引玉,希望能够对这一学科的发展有所裨益!
[1] SCOTT A R,KAISER W R.Thermogenic and secondary biogenic gases,San Juan Basin,Colorado and New Mexico:implications for coalbed gas producibility [J].American Association of Petroleum Geologists Bulletin,1994,78(8):1186-209.
[2] FAIZ M,HENDRY P.Significance of microbial activity in Australian coalbed methane reservoirs:a review [J].Bullentin of Canadian Petroleum Geology,2006,54(3):261-272.
[3] SHIMIZU S,AKIYAMA M,NAGANUMA T,et al.Molecular characterization of microbial communities in deep coal seam groundwater of northern Japan [J].Geobiology,2007,5(4):423-433.
[4] GUO H,LIU R,YU Z,et al.Pyrosequencing reveals the dominance of methylotrophic methanogenesis in a coalbed methane reservoir associated with Eastern Ordos Basin in China [J].International Journal of Coal Geology,2012,93:56-61.
[5] FLORES R M,RICE C A,STRICKER G D,et al.Methanogenic pathways of coalbed gas in the Powder River Basin,United States:the geologic factor [J].International Journal of Coal Geology,2008,76(1/2):52-75.
[6] PAPENDICK S L,DOWNS K R,VO K D,et al.Biogenic methane potential for Surat Basin,Queensland coal seams [J].International Journal of Coal Geology,2011,88(2):123-134.
[7] FU H,YAN D,YANG S,et al.Characteristics of in situ stress and its influence on coalbed methane development:a case study in the eastern part of the southern Junggar Basin,NW China [J].Energy Science & Engineering,2019,8(2):515-529.
[8] Scott A R.Improving coal gas recovery with microbially enhanced coalbed methane[C]//MASTALETCZ M,GLIKSON M,GOLDING S.Coalbed Methane: Scientific,Environmental,and Economic Evaluations[R].Netherlands: Kluwer Academic Publishers,1999:89-111.
[9] GREEN M S,FLANEGAN K C,GILCREASE P C.Characterization of a methanogenic consortium enriched from a coalbed methane well in Powder River Basin,USA [J].International Journal of Coal Geology,2008,76(1/2):34-45.
[10] GUPTA P,GUPTA A.Biogas production from coal via anaerobic fermentation [J].Fuel,2014,118:238-242.
[11] RATHI R,PRIYA A,VOHRA M,et al.Development of a microbial process for methane generation from bituminous coal at thermophilic conditions [J].International Journal of Coal Geology,2015,147/148:25-34.
[12] YANG X,GENG B,ZHU C,et al.Fermentation performance optimization in an ectopic fermentation system [J].Bioresour Technol,2018,260:329-337.
[13] STRAPOC D,MASTALERZ M,EBLE C,et al.Characterization of the origin of coalbed gases in southeastern Illinois Basin by compound-specific carbon and hydrogen stable isotope ratios[J].Organic Geochemistry,2007,38(2): 267-287.
[14] MIDGLEY D J,HENDRY P,PINETOWN K L,et al.Characterisation of a microbial community associated with a deep,coal seam methane reservoir in the Gippsland Basin,Australia [J].International Journal of Coal Geology,2010,82(3/4):232-239.
[15] TANG Y Q,JI P,LAI G L,et al.Diverse microbial community from the coalbeds of the Ordos Basin,China [J].International Journal of Coal Geology,2012,90/91(1):21-33.
[16] JONES E J P,VOYTEK M A,CORUM M D,et al.Stimulation of methane generation from nonproductive coal by addition of nutrients or a microbial consortium [J].Applied and Environmental Microbiolgy,2010,76(21):7013-7022.
[17] FALLGREN P H,ZENG C,REN Z,et al.Feasibility of microbial production of new natural gas from non-gas producing lignite [J].International Journal of Coal Geology,2013,115:79-84.
[18] RITTER D,VINSON D,BARNHART E,et al.Enhanced microbial coalbed methane generation:a review of research,commercial activity,and remaining challenges [J].International Journal of Coal Geology,2015,146:28-41.
[19] LI Y,SUN Y,LI L,et al.Acclimation of acid tolerant methanogenic propionate utilizing culture and microbial community dissecting [J].Bioresource Technolgy,2018,250:117-123.
[20] TIAN H,FOTIDIS I A,MANCINI E,et al.Acclimation to extremely high ammonia levels in continuous biomethanation process and the associated microbial community dynamics [J].Bioresour Technol,2018,247:616-623.
[21] 苏现波,陈 鑫,夏大平,等.白腐真菌对不同煤阶煤的降解作用研究[J].河南理工大学学报:自然科学版,2013,32(3):38-41.
SU Xianbo,CHEN Xin,XIA Daping,et al.Study on degradation of different rank coals by white-rot fungus [J].Journal of Henan Polytechnic University:Natural Science,2013,32(3):38-41.
[22] 王龙贵,张明旭,欧泽深,等.白腐真菌降解转化煤炭的机理研究[J].煤炭科学技术,2006,34(3): 40-43.
WANG Longgui,ZHANG Mingxu,OU Zeshen,et al.Mechanism study on coal degradation and converted with white rot funguses[J].Coal Science and Technology,2006,34(3): 40-43.
[23] FAKOUSSA R M,HOFRICHTER M.Biotechnology and microbiology of coal degradation [J].Appl Microbiol Biotechnol,1999,52(1):25-40.
[24] HUANG Z,URYNOWICZ,MICHAEL A,et al.Stimulation of biogenic methane generation in coal samples following chemical treatment with potassium permanganate [J].Fuel,2013,111(5):813-819.
[25] WANG Q,GUO H,WANG H,et al.Enhanced production of secondary biogenic coalbed natural gas from a subbituminous coal treated by hydrogen peroxide and its geochemical and microbiological analyses [J].Fuel,2019,236:1345-1355.
[26] 李亚平,郭红光,韩 青,等.水稻秸秆与煤共降解增产煤层生物甲烷试验研究 [J].煤炭科学技术,2018,46(4):215-221.
LI Yaping,GUO Hongguang,HAN Qing,et al.Experimental research on enchaning biogenic methane production in coal seam by co-degradation of rice straw and coal [J].Coal Science and Technology,2018,46(4):215-221.
[27] GUO H,CHENG Y,HUANG Z,et al.Factors affecting co-degradation of coal and straw to enhance biogenic coalbed methane [J].Fuel,2019,244:240-246.
[28] FAIZ M,STALKER L,SHERWOOD N,et al.Bio-enhancement of coalbed methane resources in the Southern Sydney Basin [J].Appea Journal,2003,43(1):595-610.
[29] 苏佳纯,肖 钢.利用微生物促进煤层间 CO2甲烷化的新方法 [J].煤炭转化,2013,36(4):90-93.
SU Jiagang,XIAO Gang.A proposed pathway to stimulate biogenic methane production from coal and injected carbon dioxide [J].Coal Conversion,2013,36(4):90-93.
[30] 孙 斌,李金珊,承 磊,等.低阶煤生物采气可行性:以二连盆地吉尔嘎朗图凹陷为例 [J].石油学报,2018,39(11):1272-1278.
SUN Bin,LI Jinshan,CHENG Lei,et al.The feasibility of biological gas recovery in low-rank coal:a case study of Jiergalangtu depression in Erlian Basin [J].Acta Petrolei Sinica,2018,39(11):1272-1278.
[31] KURR M,HUBER R,K NIG H,et al.Methanopyrus kandleri,gen and sp nov represents a novel group of hyperthermophilic methanogens,growing at 110℃ [J].Archives of Microbiology,1991,156(4):239-247.
[32] PEDERSEN K.Exploration of deep intraterrestrial microbial life:current perspectives [J].FEMS Microbiology Letters,2000,185:9-16.
[33] PARKES R J,CRAGG B A,WELLSBURY P.Recent studies on bacterial populations and processes in subseafloor sediments:a review [J].Hydrogeology Journal,2000,8(1):11-28.
[34] SU X,ZHAO W,XIA D.The diversity of hydrogen-producing bacteria and methanogens within an in situ coal seam [J].Biotechnol for Biofuels,2018,11:245.
[35] LI D,HENDRY P,FAIZ M.A survey of the microbial populations in some Australian coalbed methane reservoirs [J].International Journal of Coal Geology,2008,76(1/2):14-24.
[36] KLEIN D A,FLORES R M,VENOT C,et al.Molecular sequences derived from Paleocene Fort Union Formation coals vs associated produced waters:implications for CBM regeneration [J].International Journal of Coal Geology,2008,76(1/2):3-13.
[37] FRY J C,HORSFIELD B,SYKES R,et al.Prokaryotic populations and activities in an interbedded coal deposit,including a previously deeply buried section (1.6~2.3 km) above 150 Ma basement rock [J].Geomicrobiol Journal,2009,26(3):163-178.
[38] PENNER T J,FOGHT J M,BUDWILL K.Microbial diversity of western Canadian subsurface coal beds and methanogenic coal enrichment cultures [J].International Journal of Coal Geology,2010,82(1/2):81-93.
[39] SU X,ZHAO W,XIA D,et al.Contribution of Microbial Acclimation to Lignite Biomethanization[J].Energy & Fuels,2020,34(3):3223-3238.
[40] ZHANG J,PARK S Y,LIANG Y,et al.Finding cost-effective nutrient solutions and evaluating environmental conditions for biogasifying bituminous coal to methane ex situ[J].Applied Energy,2016,165: 559-568.
[41] WEI M,YU Z,JIANG Z,et al.Microbial diversity and biogenic methane potential of a thermogenic-gas coal mine [J].International Journal of Coal Geology,2014,134/135:96-107.
[42] GALLAGHER L K,GLOSSNER A W,LANDKAMER L L,et al.The effect of coal oxidation on methane production and microbial community structure in Powder River Basin coal [J].International Journal of Coal Geology,2013,115:71-178.
[43] JI Z,LIANG Y,PANDEY R,et al.Characterizing microbial communities dedicated for conversion of coal to methane in situ and ex situ [J].International Journal of Coal Geology,2015,146:145-154.
[44] BAO Y,HUANG H ,HE D,et al.Microbial enhancing coal-bed methane generation potential,constraints and mechanism:a mini-review[J].Journal of Natural Gas Science & Engineering,2016,35:68-78.
[45] STRAPOC D,MASTALERZ M,DAWSON K,et al.Biogeochemistry of Microbial Coal-Bed Methane[J].Annual Review of Earth & Planetary Sciences,2011,39(1):617-656.
[46] BARNHART E P,DE LE N K B,RAMSAY B D,et al.Investigation of coal-associated bacterial and archaeal populations from a diffusive microbial sampler (DMS) [J].International Journal of Coal Geology,2013,115:64-70.
[47] SINGH D N,KUMAR A,SARBHAI M P,et al.Cultivation-independent analysis of archaeal and bacterial communities of the formation water in an Indian coal bed to enhance biotransformation of coal into methane [J].Appl Microbiol Biotechnol,2012,93(3):1337-1350.
[48] STRAPOC D,PICARDAL F W,TURICH C,et al.Methane-producing microbial community in a coalbed of the Illinois Basin [J].Appl Environ Microbiol,2008,74(12):2424-2455.
[49] WEI M,YU Z,ZHANG H.Microbial diversity and abundance in a representative small-production coal mine of Central China [J].Energy Fuels,2013,27(7):3821-3829.
[50] STRAPOC D,ASHBY M,WOOD L,et al.Significant contribution of methyl/methanol-utilising methanogenic pathway in a subsurface biogas environment[C]//Applied microbiology and molecular biology in oilfield systems.Berlin: Springer,2010:211-216.
[51] HARMS C,SCHLEICHER A,COLLINS M D,et al.Tissierella creatinophila sp nov,a gram positive,anaerobic,non-spore forming,creatinine fermenting organism [J].International Journal of Systematic Bacteriology,1998,48(3): 983-993.
[52] MARA K,DECOROSI F,VITI C,et al.Molecular and phenotypic characterization of Acinetobacter strains able to degrade diesel fuel [J].Res Microbiol,2012,163(3):161-172.
[53] BREITENSTEIN A,WIEGEL J,HAERTIG C,et al.Reclassification of Clostridium hydroxybenzoicum as sedimentibacter hydroxybenzoicus gen nov,comb nov,and description of Sedimentibacter saalensis sp nov [J].International Journal of Systematic & Evolutionary Microbiology,2002,52(3):801-807.
[54] ARIMA K,KAKINUMA A,TAMURA G.Surfactin,a crystalline peptidelipid surfactant produced by Bacillus subtilis:isolation,characterization and its inhibition of fibrin clot formation [J].Biochem Biophys Res Commun,1968,31(3):488-494.
[55] SAUER K,CAMPER A K,EHRLICH G D,et al.Pseudomonas aeruginosa displays multiple phenotypes during development as a biofilm [J].J Bacteriol,2002,184(4):1140-1154.
[56] WANG J,CEN B,HAI S.Biology and epidemiology of bacterial wilt caused by pseudomonas solanacearum [J].Annu Rev Phytopathol,1997,29(1):65-81.
[57] HAHNKE S,LANGER T,KLOCKE M.Proteiniborus indolifex sp nov,isolated from a thermophilic industrial-scale biogas plant [J].International Journal of Systematic & Evolutionary Microbiology,2018,68(3):824-828.
[58] CHENS,DONG,Y,et al.Proteiniphilum acetatigenes gen nov,sp nov,from a UASB reactor treating brewery wastewater [J].International Journal of Systematic & Evolutionary Microbiology,2005,55(6):2257-2261.
[59] MIYAZAKI M,SAKAI S,RITALAHTI K M,et al.Sphaero-chaeta multiformis sp nov:an anaerobic,psychrophilic bacterium isolated from subseafloor sediment,and emended description of the genus Sphaerochaeta [J].International Journal of Systematic & Evolutionary Microbiology,2014,64(12):4147-4154.
[60] 宋金星,郭红玉,陈山来,等.煤中显微组分对生物甲烷代谢的控制效应 [J].天然气工业,2016,36(5):25-30.
SONG Jinxing,GUO Hongyu,CHEN Shanlai,et al.Control effects of coal maceral composition on the metabolism of biogenic methane.[J].Natrual Gas Industry,2016,36(5):25-30.
[61] JABARI L,GANNOUN H,CAYOL J L,et al.Macellibacteroides fermentans gen nov,sp nov,a member of the family porphyromonadaceae isolated from an upflow anaerobic filter treating abattoir wastewaters [J].International Journal of Systematic & Evolutionary Microbiology,2012,62(10):2522-2527.
[62] GRABOWSKI A,TINDALL B J,BARDIN V,et al.Petrimonas sulfuriphila gen nov,sp nov:a mesophilic fermentative bacterium isolated from a biodegraded oil reservoir [J].International Journal of Systematic & Evolutionary Microbiology,2005,55:1113-1121.
[63] MATTHIES C,EVERS S,LUDWIG W,et al.Anaerovorax odorimutans gen nov,sp nov:a putrescine-fermenting,strictly anaerobic bacterium [J].International Journal of Systematic & Evolutionary Microbiology,2000,50(4):1591-1594.
[64] DENG Y,GUO X,WANG Y,et al.Terrisporobacter petrolearius sp nov:isolated from an oilfield petroleum reservoir [J]. International Journal of Systematic & Evolutionary Microbiology,2015,65(10):3522-3526.
[65] ROBERTSON W,BOWMAN J,FRANZMANN P,et al.Desulfosporosinus meridiei sp nov:a spore-forming sulfate-reducing bacterium isolated from gasolene-contaminated groundwater [J].Int J Syst Evol Microbiol,2001,51(1):133-140.
[66] 华 涛,李胜男,邸志珲,等.微生物降解石油污染物机制研究进展 [J].生物技术通报,2018,34(10):32-40.
HUA Tao,LI Shengnan,DI Zhihui,et al.Review on mechanism and application of microbe degrading petroleum pollutants[J].Biotechnology Bulletin,2018,34(10):32-40.
[67] 沈冬钱.代谢工程大肠杆菌积累丙酮酸的研究 [D].杭州:浙江大学,2014.
SHEN Dongqian. Study on pyruvic acid accumulation of escherichia coli[D].Hangzhou:Zhejiang University,2014.
[68] 包永明,王天琪,姬芳玲.细菌3-羟基丁酮及氧化还原产物代谢的研究进展 [J].微生物学杂志,2014,34(4):1-6.
BAO Yongming,WANG Tianqi,JI Fangling.Progress of acetoin and its redox product metabolism in bacteria[J].Journal of Microbiology,2014,34(4):1-6.
[69] 王 硕.产氢产乙酸优势菌群构建及其对厌氧消化系统的强化效应 [D].哈尔滨:哈尔滨工业大学,2009.
WANG Shuo. Construction of dominant hydrogen-producing acetogens and the bioaugmentation for developing the efficacy of anaerobic waste water treatment system[D].Harbin: Harbin Institute of Technology,2009.
[70] BAENA S,FARDEAU M L,LABAT M,et al.Aminobacterium mobile sp nov:a new anaerobic amino-acid-degrading bacterium [J].Int J Syst Evol Microbiol,2000,50(1):259-264.
[71] IMACHI H,SAKAI S,KUBOTA T,et al.Sedimentibacter acidaminivorans sp nov:an anaerobic,amino-acid-utilizing bacterium isolated from marine subsurface sediment [J].International Journal of Systematic & Evolutionary Microbiology,2016,66(3):1293-1300.
[72] MAGOT M,RAVOT G,CAMPAIGNOLLE X,et al.Dethiosulfovibrio peptidovorans gen nov sp nov:a new anaerobic,slightly halophilic,thiosulfate-reducing bacterium from corroding offshore oil wells [J].Int J Syst Bacteriol,1997,47(3):818-824.
[73] SIMON,POIRIER,ARIANE,et al.Community shifts within anaerobic digestion microbiota facing phenol inhibition:towards early warning microbial indicators[J].Water Res,2016,100:296-305.
[74] 赵 玲.丁二酮产生菌的选育及代谢控制发酵研究 [D].大连:大连理工大学,2008.
ZHAO Ling. Selection and fermentation of enterbacter aerogenes mutant for diacetyl production[D].Dalian: Dalian University of Technology,2008.
[75] BRYANT M P,CAMPBELL L L,REDDY C A,et al.Growth of desulfovibrio in lactate or ethanol media low in sulfate in association with H2 utilizing methanogenic bacteria [J].Appl Environ Microbiol,1977,33(5):1162-1169.
[76] 李煜珊,李耀明,欧阳志云.产甲烷微生物研究概况 [J].环境科学,2014,35(5):2025-2030.
LI Yushan,LI Yaoming,OUYANG Zhiyun.Research overview of methanogens [J].Environmental Science,2014,35(5):2025-2030.
[77] 张 瑞,雍晓雨,周 俊,等.分子生物学技术在产甲烷古菌多样性研究中的应用 [J].江苏农业科学,2015(1):16-20.
ZHANG Rui,YONG Xiaoyu,ZHOU Jun,et al.Application of molecular biology techniques in the study of methanogenic archaea diversity[J].Jiangsu Agricultural Science,2015(1):16-20.
[78] 方晓瑜,李家宝,芮俊鹏,等.产甲烷生化代谢途径研究进展 [J].应用与环境生物学报,2015,21(1):1-9.
FANG Xiaoyu,LI Jiabao,RUI Junpeng,et al.Research progress in biochemical pathways of methanogenesis.[J].Chin J Appl Environ Biol,2015,21(1):1-9.
[79] WEIMER P J,ZEIKUS J G.One carbon metabolism in methanogenic bacteria:cellular characterization and growth of methanosarcina barkeri [J].Archives of Microbiology,1978,119(1):49-57.
[80] CONRAD R,BAK F,J S H.Hydrogen turnover by psychrotrophic homoacetogenic and mesophilic methanogenic bacteria in anoxic paddy soil and lake sediment [J].FEMS Microbiology Letters,1989,62(5):285-293.
[81] WHITICAR M J.Carbon and hydrogen isotope systematics of bacterial formation and oxidation of methane [J].Chemical Geology,1999,161(1/3):291-314.
[82] JONES W J,PAYNTER M J B,GUPTA R.Characterization of methanococcus maripaludis sp nov:a new methanogen isolated from salt marsh sediment [J].Archives of Microbiology,1983,135(2):91-7.
[83] KUMAR C A,PIER-LUC T,HOLMES D E,et al.Genetic evidence that the degradation of para-cresol by geobacter metallireducens is catalyzed by the periplasmic para-cresol methylhydroxylase [J].FEMS Microbiology Lett,2015,362(20):1-20.
[84] 李艳霞.嗜热土壤脱氮芽孢杆菌NG80-2降解苯环化合物的蛋白组学研究和维氏气单胞菌B565基因组学分析 [D].天津:南开大学,2012.
LI Yanxia. Proteomics analysis of aromatic catabolic pathways in thermophilic geobacillus thermodenitrificans NG80-2 and com-plete genome sequence of Aeromonas Veronii Strain B565[D]. Tianjin:Nankai University,2012.
[85] 周 蕾.厌氧烃降解产甲烷菌系的组成及其代谢产物的特征 [D].上海: 华东理工大学,2012.
ZHOU Lei. Microbial community composition and metabolites in methanogenicpetroleum hydrocarbon-degrading consortia[D]. Shanghai:East China University of Science and Technology,2012.
[86] 沈李东,郑 平,胡宝兰.自然生态系统中的厌氧氨氧化 [J].生态学报,2011,31(15):4447-4454.
SHEN Lidong,ZHENG Ping,HU Baolan.Anaerobic ammonium oxidation in natural ecosystems.[J].Acta Ecologica Sinica,2011,31(15):4447-4454.
[87] MURCHISON D G.Coal petrography [J].Nature,1963,200(4908):740.
[88] ROBBINS S J,EVANS P N,ESTERLE J S,et al.The effect of coal rank on biogenic methane potential and microbial composition [J].International Journal of Coal Geology,2016,154:205-2112.
[89] 张怀文,夏大平,赵伟仲.不同煤阶煤的发酵制氢研究 [J].可再生能源,2018,37(5):11-16.
ZHANG Huaiwen,XIA Daping,ZHAO Weizhong.Study on the generation characteristics of hydrogen from different coal ranks [J].Renewable Energy Resources,2018,37(5):11-16.
[90] FALLGREN P H,JIN S,ZENG C,et al.Comparison of coal rank for enhanced biogenic natural gas production [J].International Journal of Coal Geology,2013,115:92-96.
[91] BORIS W,MARGARITA M,PARISI V A,et al.Field and laboratory studies on the bioconversion of coal to methane in the San Juan Basin [J].FEMS Microbiology Ecol,2011,81(1):1-17.
[92] YOUNASMALIK A,ISHTIAQALI M,ASIFJAMAL,et al.Coal biomethanation potential of various ranks from Pakistan:a possible alternative energy source [J].Journal of Cleaner Production,2020,225(1):12-20.
[93] OLESZKIEWICZ J A,SHARMA V K.Stimulation and inhibition of anaerobic processes by heavy metals:a review [J].Biological Wastes,1990,31(1):45-67.
[94] 孙 娟,李 东,郑 涛,等.微量元素对蔬菜废弃物连续厌氧消化系统微生物群落结构的影响 [J].应用与环境生物学报,2019,25(1):156-613.
SUN Juan,LI Dong,ZHENG Tao,et al.Effects of trace elements on microbial community structure in continuous anaerobic digestion of vegetable waste.[J]Chin J Appl Environ Biol,2019,25(1):156-613.
[95] CAO W,WANG M,LIU M,et al.The chemical and dynamic distribution characteristics of iron,cobalt and nickel in three different anaerobic digestates:effect of pH and trace elements dosage[J].Bioresour Technology,2018,269:363-374.
[96] GUSTAVSSON J,YEKTA S S,SUNDBERG C,et al.Bioavailability of cobalt and nickel during anaerobic digestion of sulfur-rich stillage for biogas formation [J].Applied Energy,2013,112:473-477.
[97] MOESTEDT J,NORDELL E,SHAKERI YEKTA S,et al.Effects of trace element addition on process stability during anaerobic co-digestion of OFMSW and slaughter house waste [J].Waste Manage,2015,47:11-20.
[98] 夏大平,兰建义,陈 曦,等.微量元素在煤层生物甲烷形成时激励与阻滞体系研究 [J].煤炭学报,2017,42(5):1230-1235.
XIA Daping,LAN Jianyi,CHEN Xi,et al.Study on the excition and blocking system of trace elements in coals on the production of biogenic methane [J].Journal of China Coal Society,2017,42(5):1230-1235.
[99] SHLIMON A G,FRIEDRICH M W,NIEMANN H,et al.Methanobacterium aarhusense sp nov:a novel methanogen isolated from a marine sediment (Aarhus Bay,Denmark) [J].International Journal of Systematic & Evolutionary Microbiology,2004,54(3):759-763.
[100] 苏现波,吴 昱,夏大平,等.温度对低煤阶煤生物甲烷生成的影响 [J].煤田地质与勘探,2012,40(5):24-26.
SU Xianbo,WU Yu,XIA Daping,et al.Effect of temperature on biologicla methane generation of low rank coal [J].Coal Geology & Exploration,2012,40(5):24-26.
[101] 关德师.甲烷菌的生存条件与生物气 [J].天然气工业,1990,10(5):13-19.
GUAN Deshi.The living conditions of methanogens and biogas.[J].Natural Gas Industry,1990,10(5):13-19.
[102] 王艳婷,韩娅新,何 环,等.褐煤生物产气影响因素研究 [J].煤炭科学技术,2013,41(11):120-128.
WANG Yanting,HAN Yaxin,HE Huan,et al.Study on influencing factors for biogenic gas production in lignite [J].Coal Science and Technology,2013,41(11):120-128.
[103] 陈 浩,秦 勇,邓 泽,等.二连盆地吉尔嘎朗图凹陷低煤阶煤层生物产气影响因素 [J].天然气工业,2018,38(6):27-32.
CHEN Hao,QIN Yong,DENG Ze,et al.Factors influencing the biogenic gas production of low rank coal beds in Jiergalangtu sag,Erlian Basin [J].Natural Gas Industry,2018,38(6):27-32.
[104] 林 海,李洋子,汪 涵,等.产甲烷菌的诱变及其对煤层气产出的影响 [J].煤炭学报,2012,37(S2):407-411.
LIN Hai,LI Yangzi,WANG Han,et al.Mutagenesis of methanogen and the impact of coalbed methane outputting [J].Journal of China Coal Society,2012,37(S2):407-411.
[105] JIN Y,LIN Y,WANG P,et al.Volatile fatty acids production from saccharification residue from food waste ethanol fermentation:effect of pH and microbial community [J].Bioresour Technology,2019,292:1219-1257.
[106] YAN Y,FENG L,ZHANG C,et al.Ultrasonic enhancement of waste activated sludge hydrolysis and volatile fatty acids accumulation at pH 10.0 [J].Water Res,2010,44(11):3329-3336.
[107] WANG K,YIN J,SHEN D,et al.Anaerobic digestion of food waste for volatile fatty acids (VFAs) production with different types of inoculum:effect of pH [J].Bioresour Technol,2014,161:395-401.
[108] 苏现波,徐 影,吴 昱,等.盐度、pH对低煤阶煤层生物甲烷生成的影响 [J].煤炭学报,2011,36(8):1302-1306.
SU Xianbo,XU Ying,WU Yu,et al.Effect of salinity and pH on biogenic methane production of low-rank coal [J].Journal of China Coal Society,2011,36(8):1302-1306.
[109] 林 海,隋梦琪,汪 涵.微生物增产煤层气菌种的驯化 [J].煤炭学报,2012,37(8):1359-1363.
LIN Hai,SUI Mengqi,WANG Han.Domestication of microbial enhanced coalbed methane microorganism [J].Journal of China Coal Society,2012,37(8):1359-1363.
[110] 苏现波,陈 鑫,夏大平.煤发酵制生物氢和甲烷的模拟试验 [J].天然气工业,2014,34(5):179-185.
SU Xianbo,CHEN Xin,XIA Daping,et al.An experimental study of hydrogen and methane production from fermentation coal [J].Natural Gas Industry,2014,34(5):179-185.
[111] 郭红光,王 飞,李治刚.微生物增产煤层气技术研究进展 [J].微生物学通报,2015,42(3):584-90.
GUO Hongguang,WANG Fei,LI Zhigang.Research progress of microbial enhanced coalbed methane [J].Microbiology China,2015,42(3):584-590.
[112] 王 尚,董海良,侯卫国,等.微生物在生物煤层气形成中的作用及影响因素研究进展 [J].地球与环境,2013,41(4):335-345.
WANG Shang,DONG Hailiang,HOU Weiguo,et al.Isotopic and microbiological characteristics of secondary biogenic coalbed methane [J].Earth and Environment,2013,41(4):335-345.
[113] 傅 霖,辛明秀.产甲烷菌的生态多样性及工业应用 [J].应用与环境生物学报,2009,15(4):574-578.
FU Lin,XIN Mingxiu.Ecological diversity and industrial application of methanogens [J].Chinese Journal of Applied and Environmental Biology,2009,15(4):574-578.
[114] 汪 涵,林 海,董颖博,等.外源产甲烷菌降解褐煤产气试验 [J].石油勘探与开发,2012,39(6):764-768.
WAN Han,LIN Hai,DONG Yingbo,et al.Experiments on the gas production of brown coal degraded by exogenous methanogens [J].Petroleum Exploration and Development,2012,39(6):764-768.
[115] 聂志强,杨秀清,韩作颖.不同煤阶生物成因煤层气微生物群落的功能及多样性研究进展 [J].微生物学通报,2018,46(5):1127-1135.
NIE Zhiqiang,YANG Xiuqing,HAN Zuoying.Function and diversity of microbial community in biogenic coal-bed methane with different coal ranks:a review [J].Microbiology China,2019,46(5):1127-1135.
[116] 夏大平,陈 鑫,苏现波,等.氧化还原电位对低煤阶煤生物甲烷生成的影响 [J].天然气工业,2012,32(11):107-110.
XIA Daping,CHEN Xin,SU Xianbo,et al.Impact of oxidation-reduction potential on the generation of biogenic methane in low-rank coals [J].Natrual Gas Industry,2012,32 (11):107-110.
[117] 乔留虎,夏大平,唐书恒,等.低煤阶煤产气量的pH 和Eh 控制 [J].煤田地质与勘探,2016,44(4):73-76.
QIAO Liuhu,XIA Daping,TANG Shuheng,et al.The control of pH and Eh of the gas production of low rank coal [J].Coal Geology & Exploration,2016,44(4):73-76.
[118] 李 茹,万吉志,吴溪俊,等.生物成因煤层气产气原理及影响因素研究进展 [J].煤炭工程,2013,45(S1):129-131.
LI Ru,WAN Jizhi,WU Xijun,et al.Research progress on principles and influencing factors of biogenic coalbed methane[J].Coal Engineering,2013,45(S1):129-131.
[119] 郭红玉,符超勇,拜 阳,等.生物产气对煤层气可采性指标的影响 [J].天然气工业,2017,37(2):46-51.
GUO Hongyu,FU Chaoyong,BAI Yang,et al.Influence of biogenic gas production on coalbed methane recoverability parameters [J].Natural Gas Industry,2017,37(2):46-51.
[120] 葛晶丽,徐宏英,张灵利.生物成因煤层气的研究现状 [J].微生物学杂志,2016,36(4):90-95.
GE Jingli,XU Hongying,ZHANG Lingli.Research status quo of biogenic coal-bed methane [J].Journal of Microbiology,2016,36(4):90-95.
[121] 秦 勇.中国煤层气成藏作用研究进展与述评 [J].高校地质学报,2012,18(3):405-418.
QIN Yong.Advances and reviews on coalbed methane reservoir formation in china [J].Geological Journal of China Universities,2012,18 (3):405-418.
[122] 李本亮,王明明,冉启贵,等.地层水含盐度对生物气运聚成藏的作用 [J].天然气工业,2003,23(5):16-20.
LI Benliang,WANG Mingming,RAN Qigui,et al.Effect of the salinity of formation water on biogas migration,accumulation and reservoir formation [J].Natural Gas Industry,2003,23(5):16-20.
[123] 王爱宽,秦 勇.生物成因煤层气试验研究现状与进展 [J].煤田地质与勘探,2010,38(5):23-27.
WANG Aikuan,QIN Yong.Research status and progress of experimental study on biogenic coalbed methane [J].Coal Geology & Exploration,2010,38(5):23-27.
[124] 尤陆花.新疆低阶煤本源生物甲烷转化中微生物群落组成及变化 [J].微生物学通报,2014,41(12):2423-2431.
YOU Luhua,SHI Yingwu,GAO Yan,et al.Microorganism community composition and changes during low rank coal authigenous microorganism methane coversion in Xinjiang [J].Microbiology China,2014,41(12):2423-2431.
[125] 林春明,李艳丽,漆滨汶.生物气研究现状与勘探前景 [J].古地理学报,2006,8(3):317-330.
LIN Chunming,LI Yanli,QI Binwen.Research status and exploration potential of biogenic gas [J].Journal of Palaeogeography,2006,8(3):317-330.
[126] 李耀辰,鲍建国,周 旋,等.高盐度有机废水对生物处理系统的影响研究进展 [J].环境科学与技术,2006,29(6):109-111.
LI Yaochen,BAO Jianguo,ZHOU Xuan,et al.Review on biotreatment system affected by high salinity organic wastewater [J].Environmental Science & Technology,2006,29(6):109-111.
[127] 陈 润,王优阳,王琳琳,等.煤层生物气组成特征及其影响因素研究进展 [J].煤炭科学技术,2016,44(11):167-172.
CHEN Run,WANG Youyang,WANG Linlin,et al.Research progress on characteristics of biogenic coalbed gases and its influence factors [J].Coal Science and Technology,2016,44(11):167-172.
[128] MYERS T.Groundwater management and coal bed methane development in Powder River Basin of Montana [J].Journal of Hydrology,2009,368(1/2/3/4):178-93.
[129] PARK S Y,LIANG Y.Biogenic methane production from coal:a review on recent research and development on microbially enhanced coalbed methane (MECBM) [J].Fuel,2016,166:58-67.
[130] 阿拉坦其其格.能降解风化煤微生物的筛选及初步鉴定 [D].呼和浩特:内蒙古农业大学,2011.
ALTANCHEQI. Screening and identification of degradating weathered coalstrains[D].Huhhot:Inner Mongolia Agricultural University,2011.
[131] 尹向阳.煤化工废水特征污染物降解菌的筛选及功能菌群降解性能研究 [D].青岛:青岛科技大学,2019.
YIN Xiangyang. Screening of characteristic pollutant degarding bacteria and degardation performance of functional bacteria in coal chemical waste water[D]. Qingdao:Qingdao University of Science and Technology,2019.
[132] 占 迪,何 环,廖远松,等.褐煤强化产甲烷菌群的群落分析及条件优化 [J].微生物学报,2018,58(4):684-698.
ZHAN Di,HE Huan,LIAO Yuansong,et al.Community structure analysis of methanogenic flora andoptimization for bioaugmentation methane generation from lignite[J].Acta Microbiologica Sinica,2018,58(4):684-698.
[133] 张万芹,康冀川,王开功.产甲烷细菌保藏方法研究 [J].安徽农业科学,2012,40(10):61-64.
ZHANG Wanqin,KANG Jichuang,WANG Kaigong.Study on the preservation method for methanogenic bacteria[J].Journal of Anhui Agri,2012,40(10):61-64.
[134] QING GANG L I,TAO L.High-throughput sequencing technology and its application in life science [J].Animal Husbandry & Feed Science,2012,32(2): 25-28.
[135] WANG S,YANG Z,SUN Z,et al.Application of high throughput sequencing in the diversity of water microbial communities [J].Chemistry Bulletin,2014,77(3):196-203.
[136] HUBER J A,MARK WELCH D B,MORRISON H G,et al.Microbial population structures in the deep marine biosphere [J].Science,2007,318(5847):97-100.
[137] SOGIN M,MORRISON H,HUBER J,et al.Microbial diversity in the deep sea and the underexplored “rare biosphere”[J].Proceedings of the National Academy of Science of the USA,2006,103(32):12115-12120.
[138] 鲍 园. 生物成因煤层气定量判识及其成藏效应研究[D].徐州:中国矿业大学,2013.
BAO Yuan. Study on quantitative identification of biogenic coalbed methane and its reservoir formation[D]. Xuzhou: China University of Mining and Technology,2013.

