基于我国多煤少油的能源结构特点,煤制油、煤制气以及煤制化学品等煤化工行业在我国能源及化工行业占有非常重要的地位,煤化工行业产生了大量的高浓难降解有机废水,含有酚、多环芳烃、杂环化合物以及氰化物等有毒易致癌物质,给环境带来严重危害[1-3]。为实现废水“零排放”,多采用多级膜浓缩,然后蒸发结晶工艺,产生了大量可溶性国体质量分数为0.5%~10%且含有机物的高盐废水,属于高盐、高有机物、高硬度的有机废水,年产生量1亿m3左右[4]。
高级氧化工艺凭借其高效性、普适性、无二次污染等优点引起广泛关注,相较电渗析、膜处理的物理处理方法可将有机物彻底矿化,而物理处理方法仅可以实现有机物的富集。臭氧催化氧化、光催化氧化、光-芬顿氧化和电化学氧化等工艺均被用于处理反渗透浓盐水[5-6]。臭氧直接氧化存在氧化能力比较弱、矿化度低等缺点;臭氧催化氧化可产生大量氧化能力更强的·OH(羟基自由基)对有机物实现无选择性的降解,提高工艺普适性的同时提高了有机物去除率[7]。目前研究集中于市政及石化废水反渗透浓盐水,对煤化工浓盐水针对性研究较少,且研究重点集中在出水COD(化学需氧量)控制,对有机物去除机理研究涉及较少,催化剂失活机理研究也有待进一步深入[8-10]。杨静等[11]对煤制气高浓盐水(可溶性国体质量分数为0.5%)臭氧催化氧化进行研究,结果表明:颗粒活性炭、臭氧和双氧水三者之间的协同作用可明显提高·OH的浓度,高盐水中难降解有机物脱除效率约55%,但活性炭颗粒吸附作用较强,其再生较为复杂且成本高,另外针对TDS在0.5%含盐废水,较实际TDS溶解性总固体为3%~5%还有较大差距[11]。
催化臭氧氧化降解废水中有机物的工艺中应用较多的有锰、铁、铜、钴、镍等一系列过渡金属[12]。Mn的核外价电子排布式为3d54s2,在反应过程中可根据失去电子数的不同而呈现出不同的化合价,二氧化锰作为环境友好、价格低廉且结构多样、表面性质丰富、易于调控的非均相催化臭氧氧化的催化剂在工业生产及科学研究中得到了越来越多的关注[13]。
粉煤灰作为工业生产过程的废物,如不有效处理会造成大气污染等问题。随着环保政策的收紧,粉煤灰被作为工农建筑业的原料,提升产业的经济价值。但是,目前被作为原料的领域具有较低的附加值,寻求高价值的利用途径可有利于企业生产成本的降低。粉煤灰中含有多种金属元素,可作为催化剂催化有机物降解反应,因此将粉煤灰掺杂在锰基金属催化剂中有利于催化剂成本的降低且不影响催化剂的性能。
煤化工浓盐水取自山西省某焦化企业,该企业焦化废水采用预处理-生化-深度处理工艺。浓盐水取自一级反渗透的浓水出水口。为确保试验水质的稳定性,将取得的废水混合后保证均匀并保存于冰箱内。废水的溶解性固体含量为10 600 mg/L、COD 为 480 mg/L,BOD5/COD 为 0.28,pH 为 7.8,碱度为1 040 mg/L。
制备催化剂的各种化学试剂均为商品药剂,无特殊说明外均为分析纯,试验用水为自制去离子水。粉煤灰取自济南某电厂且未经过任何处理,分析显示主要成分为氧化钙、氧化硅、氧化铝,残碳含量较低。
水质COD测试采用快速消解-分光光度计国标法。催化剂制备过程如下:称取3.16 g的KMnO4溶解于40 mL去离子水中,将4.91 g的Mn(AC)2溶解后滴加到KMnO4溶液中,搅拌反应20 min后转移至水热反应釜中140 ℃反应14 h,制得MnO2粉末。将烘干的拟薄水铝石粉末与MnO2进行混合,粉煤灰掺杂比例为10%,MnO2负载质量分数为5%,添加田菁胶(质量分数为1%)、铝溶胶(占总质量的10%)等助剂混合搅拌,制成粒径3~6 mm的球状颗粒;将制得的球状湿颗粒置于室温状态下老化24 h,再置于110 ℃下干燥12 h;制得的催化剂在500 ℃下焙烧一定时间,升温速率以5 ℃/min为宜,制得球型颗粒催化剂。
以浓盐水为处理对象,以COD去除率为考核指标对催化剂的催化性能进行评价,通过调整工艺参数考察试验条件对催化效果的影响,为工业应用提供基础参数。
对粉煤灰的成分进行X射线荧光光谱(XRF)分析表征,数据结果见表1。
表1 灰成分表征结果
Table 1 Ash component characterization
成分SiO2Al2O3Fe2O3TiO2CaOMgOK2ONa2OSO3P2O5MnO2其他质量分数/%52.7517.345.920.7612.621.401.681.003.600.150.142.64
由表1可知,灰中主要含有SiO2、Al2O3、Fe2O3、CaO等成分,SiO2、Al2O3在催化剂制备过程中为优良的载体材料,成型后的催化剂在煅烧时,由于多种金属的键合作用可强化催化剂的工程强度。CaO在催化剂中掺杂后可与活性组分之间形成Mn-O-Ca二元金属氧化物,该氧化物可有效降低活性组分的浸出率、提高催化剂表面氧空位含量,进而改善催化剂的效果。
利用XRF对催化剂的元素组成进行了分析,结果见表2。数据表明催化剂的Al、Si、Ca、Mn等元素含量较高,而Zn、Fe、Ti等元素的含量较低。据此XRF数据可推测,该催化剂是以氧化铝为载体负载多种氧化物的复合催化剂,同时伴有较高含量的氧化硅和氧化钙及二氧化锰。该催化剂可解释为多相固体催化剂,以铝硅氧化物构成载体,其他多种金属化合物均匀分布于催化剂内部结构中。为进一步探究催化剂表面不同金属氧化物的组成,以便推测出催化剂主要的活性组分。利用了X射线光电子能谱(XPS)分析催化剂元素分布和价态信息。
表2 催化剂整体的元素构成
Table 2 Overall element composition of the catalyst
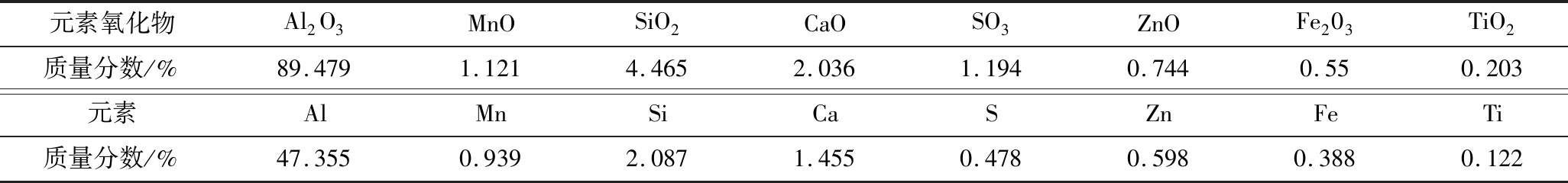
元素氧化物Al2O3MnOSiO2CaOSO3ZnOFe203TiO2质量分数/%89.4791.1214.4652.0361.1940.7440.550.203元素AlMnSiCaSZnFeTi质量分数/%47.3550.9392.0871.4550.4780.5980.3880.122
图1为催化剂全谱扫描图,图中除了XRF检测到的元素外还出现了明显的C1S峰,这主要是由催化剂的多孔结构吸附了空气中的污染物,资料显示:这个峰一般都是长链的烷基碳所呈现的峰,另一方面,合成的催化剂中含有粉煤灰,这也会出现C的吸收峰。
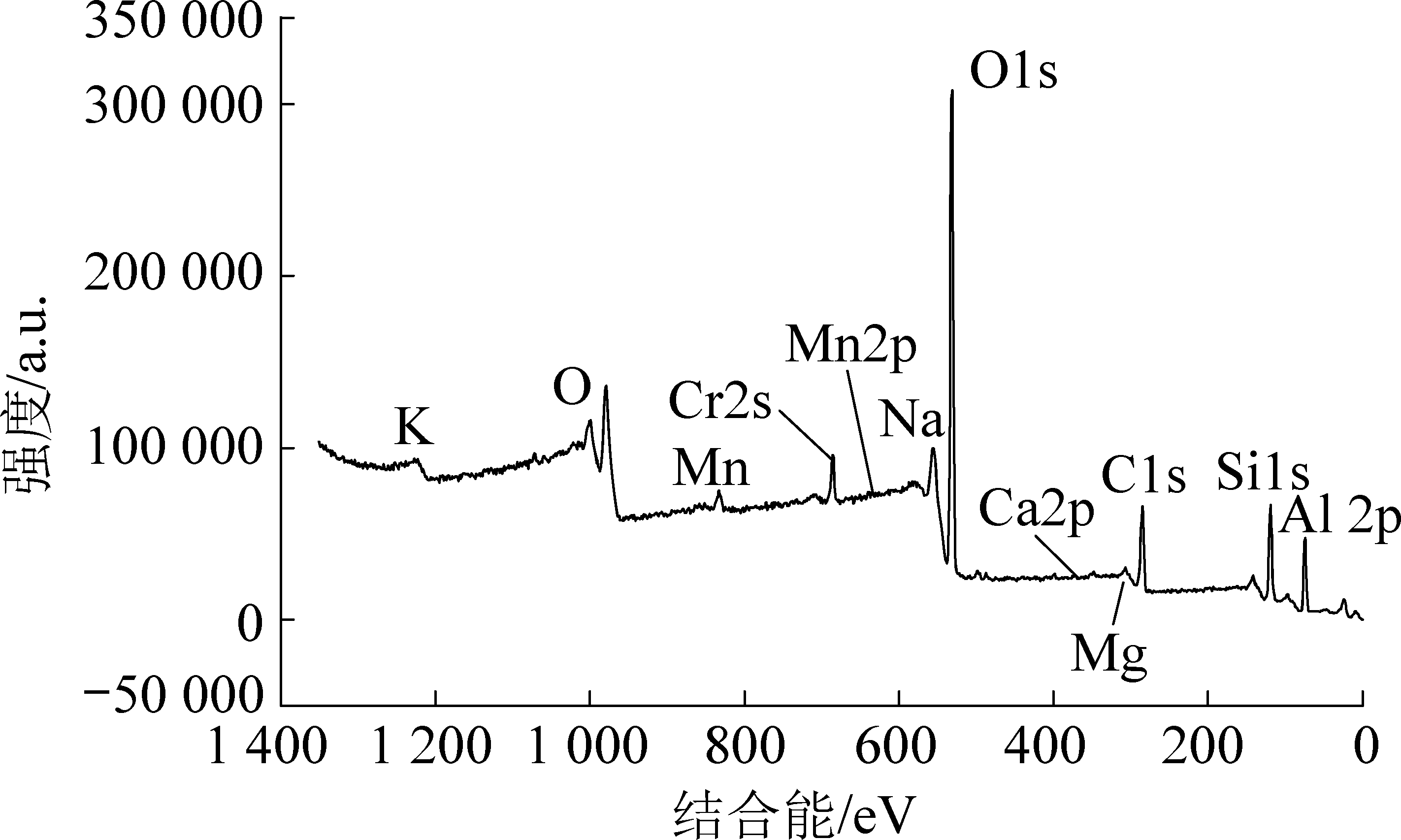
图1 催化剂的XPS全扫描图谱
Fig.1 XPS full scan spectrum of catalyst
为提高催化剂的强度在最外层滚涂了一层氧化铝粉末,而XPS表征技术为表面表征技术仅可穿透催化剂表面厚度5~10 nm,因此催化剂表面Mn元素的含量明显降低。即催化剂表面Mn元素的含量低于催化剂内部的含量,这种差异性也证明了该催化剂为核-壳式多层催化剂。
与XRF相比,催化剂表面K、Na元素的含量明显上升,推测可能是由于催化剂制备过程中经老化、离浆使得凝胶骨架收缩,部分分散介质析出。且焙烧过程也有可能会使得骨架间的物质以氧化物的形式部分溶出而聚集在表面。进一步对Si 2p,Al 2p,Fe 2p,Na 1s,与K 2p键能进行分析比较,研究结果表明,硅在2p轨道上的结合能证明Si在催化剂中主要以SiO2的形式存在,铝在2p2/3的杂化轨道上的结合能符合SiO2-(Al2O3)n的复合形式,而样品中同样含有钠主要以氧化钠的形式存在,催化剂中的K元素可能是由粉煤灰带入的。
图2为催化剂中O1s元素的XPS图谱分锋拟合曲线,由图可知锯齿状的图谱形状峰大致呈对称型,该类物质的氧元素为化合物结合态,说明催化剂中的氧元素基本上不存在单质氧。对锯齿形峰进行分峰、拟合处理,根据资料显示结合能为531.9 eV处为吸附氧而530.0 eV处的峰归属于晶格氧。527 eV右侧无杂峰出现,说明催化剂中不存在残留的H2O。根据氧空位理论催化剂表面丰富的吸附氧主要以O2-、O-、OH-等形式存在,通常认为吸附氧与氧空位有明确关系,而在有机物的降解过程中,电子云密度较大的官能团会吸附在催化剂表面的氧空位处,进而发生氧化还原反应,且氧空位又为自由基生成反应的起点,因此催化剂表面丰富的吸附氧有利于有机物的降解。

图2 催化剂中O1s元素的XPS图谱
Fig.2 XPS spectrum of O1s element in catalyst
由表2可知,EDS测试的催化剂元素组成与XRF比较接近,即催化剂的内部成分与催化剂的外部有一定的差别,复合改催化剂特殊的制备工艺。

图3 催化剂剖面EDS能谱图
Fig.3 EDS energy spectrum of catalyst profile
图3表征的结果也再次证明了催化剂含有钾、钙、钠、硅、铝、锰等元素。
表3 催化剂元素组成EDS测试结果
Table 3 EDS test results of catalyst element composition
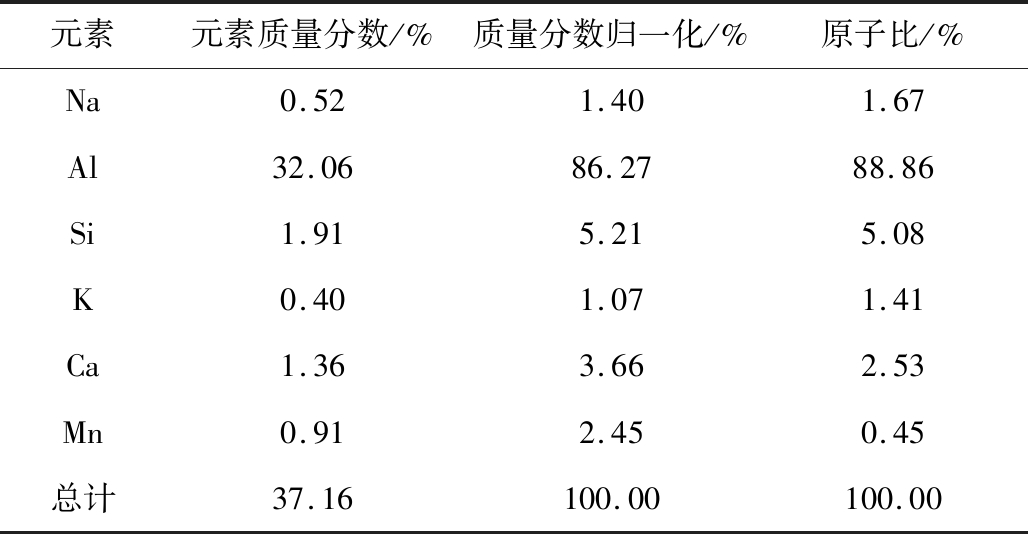
元素元素质量分数/%质量分数归一化/%原子比/%Na0.521.401.67Al32.0686.2788.86Si1.915.215.08K0.401.071.41Ca1.363.662.53Mn0.912.450.45总计37.16100.00100.00
为进一步分析催化剂内部剖面上元素分布情况,进行SEM-EDS表征,结果如图4所示,从图中可知各元素在剖面上的分布相对比较均匀,说明催化剂内部元素的分布较好。

图4 催化剂剖面SEM-EDS图谱
Fig.4 SEM-EDS spectrum of catalyst profile
由图4a可知,在催化剂截面上未发现任何裂痕或者分界面,表明催化剂无明显“载体-活性组分层”结构,图中可清晰看到多孔结构且大小孔分布比较均匀。由图5知,把Mn元素的分布规律加到SEM图上时,可以发现Mn元素分布整体比较均匀,在大孔道附近有少量的聚集。相比较之下,钙、硅、铝、钠、钾元素则非常均匀的分布在催化剂的断面上,且在孔道处有少量缺失。其中铝、钙、硅的丰度较高,属于催化剂的主体,分布规律比较接近,区域相对重合。结合之前的XRF和XPS数据的分析,可以确定该催化剂是以“铝的氧化物”为载体,钙、硅元素为载体助剂、以Mn元素为活性组分的复合型催化剂。
图4b在表征过程中发现该催化剂具有弱磁性,这主要是由二氧化锰导致的,所以催化剂的活性组分才会趋向于集中在大孔道附近,因此在多相催化反应中有机物不仅需要吸附在催化剂表面还需要渗透到孔道内部才能有效利用催化剂的催化活力[14-15]。

图5 催化剂EDS图谱
Fig.5 EDS spectrum of catalyst

图6 催化剂的SEM图
Fig.6 SEM image of catalyst
图6描述了催化剂微观形貌的SEM图像,由图6可知,催化剂表面分布大小不均一的隆起,在褶皱之间分布着大小不均一的孔道,Mn及其氧化物作为活性组分分布在催化剂内部的孔道,很有可能是因为该催化剂的载体为硅铝复合氧化物的凝胶,是多孔骨架结构,催化剂的表面和内部的孔道相互连通,使得催化剂在干燥、老化过程中由于骨架收缩产生的表面张力而出现毛细管压力的问题,活性组分通过管道渗入到催化剂内部并富集在孔道中[16]。表面丰富的隆起结构有利于有机物的吸附,强化有机物的降解效率。
Zeta电位是用来定性表征催化剂表面电荷参数的重要手段,在一定程度上还可以体现催化剂表面的酸碱度及强度[17]。考虑到在不同pH的情况下,催化剂表面电荷会表现出不同特性,这会影响到催化剂的性能(通常催化剂表面会在较高pH的条件下呈现负电,这种电性会排斥在有机介质中大部分带负电的有机物,导致催化臭氧效率降低),首先测定了不同pH条件下催化剂的Zeta电位。图7为催比剂Zeta电位随pH变化情况曲线,由图7可知,催化剂的零点电势(PZC)在pH=9附近。这表明大多数情况下,该催化剂表面带正电,而文献资料表明当催化剂位于零点电势点附近,催化臭氧的效率比较高[18]。
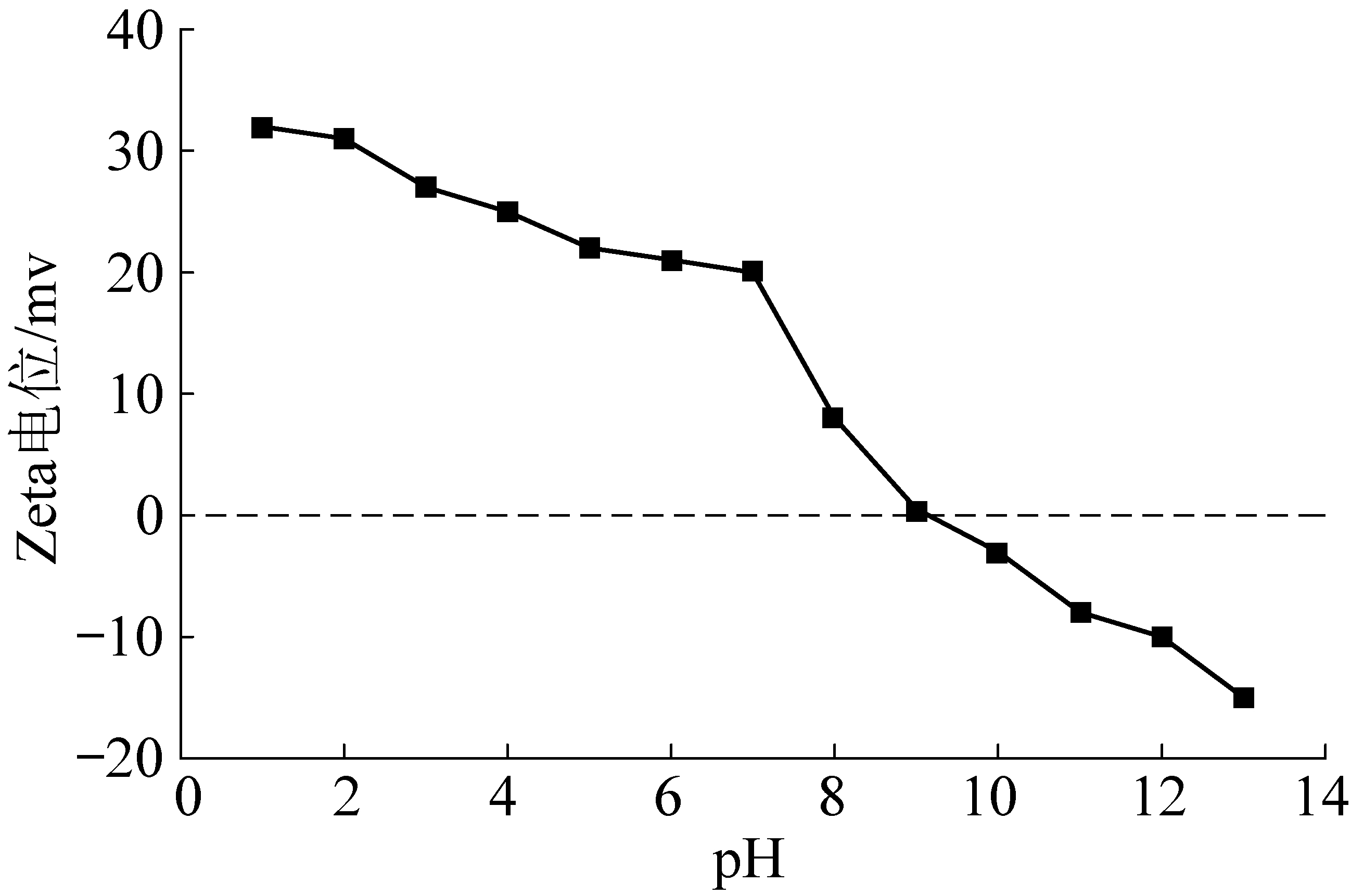
图7 催化剂的Zeta电位随pH变化情况曲线
Fig.7 Zeta potential of catalyst varies with pH
采用总容量为1.0 L的有机玻璃柱为间歇反应釜。高纯度的工业氧气作为臭氧发生器的氧气源,臭氧经过浓度检测仪、质量流量计进入反应釜;臭氧经过导管端的微孔曝气头以微气泡形式进入水溶液中,试验尾气采用还原性的碘化钾溶液吸收,在反应过程中每隔固定的时间从取样口取样测试,测试结果如图8所示。
图8a为催化剂投加量对催化性能影响的结果,结果表明,随着催化剂投加量的增加,废水COD去除率呈现先升后降的趋势,在投加量为100g时COD去除率达到最高值56%。非均相催化臭氧氧化反应属于多相流间复杂的多项反应,COD的降解效果受多方面因素的综合影响。随着催化剂量的增加,催化剂床层内的传质阻力也会逐渐增加不利于多相流间物质的接触和反应。微气泡与固体催化剂接触后会被破坏而聚集成大气泡,降低了反应的接触面积、造成反应器内形成沸腾床甚至局部流化床的现象,不稳定的床层会增大操作难度、增加设备成本更严重的会造成安全事故。因此,COD降解效果并不会随着催化剂的增加而一直增加。图8b为臭氧投加量对催化性能影响的结果,从图中可知随着臭氧投加量的增加,废水COD降解效果逐渐增加。当臭氧投加量由2 mg/L逐渐增至10 mg/L的过程中催化效果提升比较明显,COD去除率由42%增加至56%。然而,当臭氧投加量继续增加至18 mg/L时,废水COD去除率仅为62%。过高臭氧投加量会导致臭氧溶解饱和而溢出,造成臭氧浪费及环境污染。综合经济因素及试验效果,选择10 mg/L的臭氧投加量为最优量。
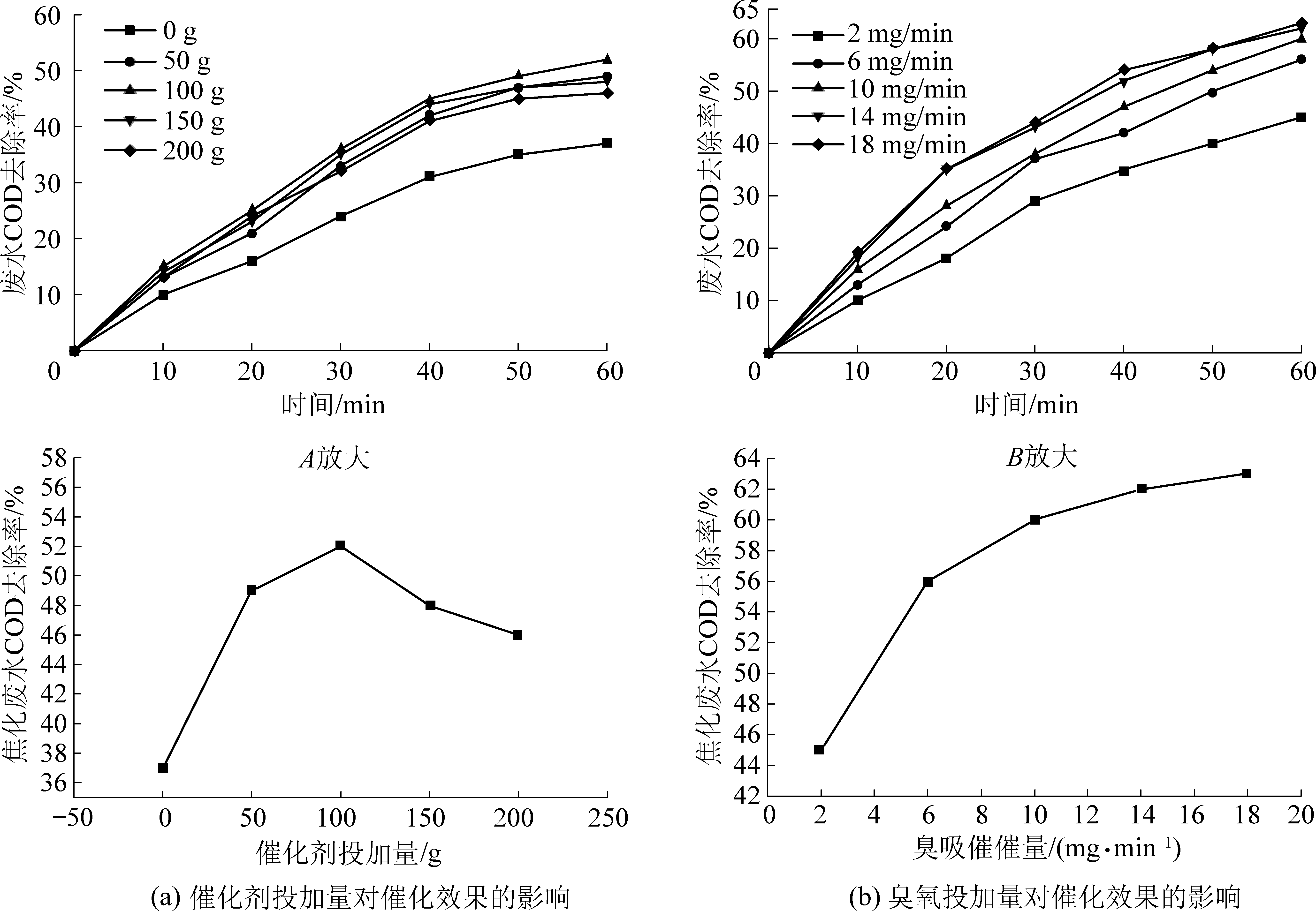
图8 催化剂(a)和臭氧(b)投加量对催化效果的影响
Fig.8 Influence of catalyst and ozone dosage on catalytic effect
对取自某地的高盐煤化工废水进行分析测试,表征结果显示含有大量的无机离子,主要离子的含量值见表3。
表4 高盐煤化工废水主要离子成分
Table 4 Main ionic components of high salt coal chemical wastewater
主要离子Ca2+Mg2+Mn2+Al3+总铁Cl-SO2-4HCO3-PO43-质量分数/(mg·L-1)45.651.541.000.240.434151.13623.88718.7750.019
由表4可知,高盐煤化工废水主要含有Ca2+、Mg2+、Mn2+及Al3+等金属阳离子,根据均相催化臭氧氧化有机物降解的机理可知,锰、铁等元素游离态的金属离子可作为催化剂,催化臭氧分解产生氧化能力更强的自由基,促进有机物的降解。另一方面,高盐废水中还含有大量的无机阴离子,且含量远大于阳离子,![]() 等碱性阴离子会降低臭氧在水溶液中的溶解度,Cl-等作为自由基捕获剂会降低反应体系自由基浓度,从而抑制了催化氧化反应。因此,水溶液中的金属阳离子可促进催化效率的提高而阴离子会抑制催化氧化效率。
等碱性阴离子会降低臭氧在水溶液中的溶解度,Cl-等作为自由基捕获剂会降低反应体系自由基浓度,从而抑制了催化氧化反应。因此,水溶液中的金属阳离子可促进催化效率的提高而阴离子会抑制催化氧化效率。
文献资料[19-20]表明,催化剂表面的酸性位点为催化臭氧氧化的活性位点,在该位点上臭氧分解产生活性自由基,而且废水的酸碱度还会影响臭氧在水溶液中的溶解度,因此,废水初始pH对反应影响较大。磷酸根比臭氧表现出更强的碱性,会与臭氧在催化剂的酸性位点上形成竞争吸附,从而阻碍自由基的生成并最终导致废水COD降解效率的降低。向反应体系中分别加入0、2 000 mg/L的磷酸钠,结果如图9a所示,加入磷酸根后COD降解率由59%降至42%,说明磷酸根的加入对催化效果影响较大。分别采用稀硫酸和氨水调节溶液的酸碱度,图9b显示的是初始pH对催化效果的影响试验结果。从图中可知,废水COD的降解效果随pH的增加先升后降,在催化剂的等电点附近催化效果最优。
为进一步确定废水中有机物的降解机理,添加叔丁醇作为羟基自由基(·OH)捕获剂、对苯醌为超氧基自由基![]() 的捕获剂,添加质量浓度均为1 000 mg/L。结果如图9c所示,加入叔丁醇的反应体系仅受到小幅度的抑制作用,COD的降解率由59%降至53%左右;然而,加入对苯醌体系的降解效果大幅度下降,反应60 min后废水COD的降解率仅为42%。说明在COD降解过程中,羟基自由基的贡献远不如超氧基自由基的大,一方面可能是对苯醌本身会消耗臭氧,阻碍了自由基的生成,另一方面也可能是高盐环境下抑制了超氧基自由基向羟基自由基转化的过程,从而导致羟基自由基的浓度较低。分别单独加入1 000 mg/L的各种钠盐,探究无机阴离子对催化反应中COD降解效果的影响,试验结果如图9d所示。数据表明,加入
的捕获剂,添加质量浓度均为1 000 mg/L。结果如图9c所示,加入叔丁醇的反应体系仅受到小幅度的抑制作用,COD的降解率由59%降至53%左右;然而,加入对苯醌体系的降解效果大幅度下降,反应60 min后废水COD的降解率仅为42%。说明在COD降解过程中,羟基自由基的贡献远不如超氧基自由基的大,一方面可能是对苯醌本身会消耗臭氧,阻碍了自由基的生成,另一方面也可能是高盐环境下抑制了超氧基自由基向羟基自由基转化的过程,从而导致羟基自由基的浓度较低。分别单独加入1 000 mg/L的各种钠盐,探究无机阴离子对催化反应中COD降解效果的影响,试验结果如图9d所示。数据表明,加入![]() 会很小程度的强化反应效果,这可能是由于离子的加入增强了溶液的导电能力,更有利于催化反应的进行。而碳酸氢根和氯离子的加入会明显降低催化剂效果,可能因为这两种阴离子会捕获自由基导致降解效果下降。
会很小程度的强化反应效果,这可能是由于离子的加入增强了溶液的导电能力,更有利于催化反应的进行。而碳酸氢根和氯离子的加入会明显降低催化剂效果,可能因为这两种阴离子会捕获自由基导致降解效果下降。

图![]() 初始pH自由基捕获剂和阴离子对COD降解的影响
初始pH自由基捕获剂和阴离子对COD降解的影响
Fig.9 Effect of ![]() pH,free radical trapping agent and anion on COD degradation
pH,free radical trapping agent and anion on COD degradation
1)催化剂表征结果显示,该催化剂为内外分布不均匀的核-壳式混合型催化剂,以氧化铝、氧化硅、氧化钙为主体,以二氧化锰为活性组分,剖面表征显示该催化剂为表面缺陷丰富的多孔催化剂
2)处理高盐废水的试验中,在催化剂投加量为100 g、臭氧投加量为10 mg/L的工艺条件下催化性能最优,反应60 min后废水COD去除率达60%左右
3)反应机理研究发现,PO43-的加入会显著降低COD的降解率,证明了表面的酸性位点为有机物降解的活性位点,![]() 对COD降解的贡献远大于·OH,废水初始pH在催化剂等电点附近时催化剂的性能最优,影响高盐废水COD降解效果的主要因素为
对COD降解的贡献远大于·OH,废水初始pH在催化剂等电点附近时催化剂的性能最优,影响高盐废水COD降解效果的主要因素为![]() 等自由基捕获剂。综合以上结论,该催化剂具有较好的适用性,臭氧催化氧化技术具有较好的工程应用前景。
等自由基捕获剂。综合以上结论,该催化剂具有较好的适用性,臭氧催化氧化技术具有较好的工程应用前景。
[1] 薛文平,薛福德,姜丽丽,等.含氰废水处理方法的进展与评述[J],黄金,2008,29(4):45-49.
XUE Wenping,XUE Fude.JLANG Lili,et al.Progress and review of cyanide-containing wastewater treatment [J].Gold,2008,29(4):45-49.
[2] RAJESH R,ABHINAV G,CHANDRAJIT B.Cyanide in industrial waste-waters and its removal:a review on biotreatment[J],Journal of Hazardous Materials,2009,163(1):1-11.
[3] 夏立全,陈贵锋,李文博,等.焦化废水处理技术发展现状及发展方向[J].洁净煤技术,2020,26(4):56-63.
XIA Liquan,CHEN Guifeng,LI Wenbo,et al.Progress and prespectives of coking wastewater trement technology [J].Clean Coal Technology,2020,26(4):56-63.
[4] 孙业涛,郭瓦力,单 译.吹脱法处理粉煤制气工艺高浓度氨氮废水[J].化学工业与工程,2010,27(6):486-489.
SUN Yetao,GUO Wali,SHAN Yi.Treatment of high-concentration ammonia nitrogen wastewater from pulverized coal gasification process by stripping process [J],Chemistry Industry and Engineering,2010,27(6):486-489.
[5] 袁 浩,电化学氧化技术深度处理焦化废水的研究进展[J],工业水处理,2018,38(1):5-9.
YUAN Hao.Research progress in the advanced treatment of coking wastewater by electrochemical oxidation technology[J].Industrial Water Treatment,2018,38(1):5-9.
[6] GAO Min Jiang.contrast on COD photo-degradation in coking wastewater catalyzed by TiO2 and TiO2-TiO2 nanorod arrays[J].Catalyst Today,2011,17(4):79-87.
[7] 郑晓英,王俭龙,李鑫玮,等.臭氧氧化深度处理二级处理出水的研究[J].中国环境科学,2014,34(5):1159-1165.
ZHENG Xiaoying,WANG Jianlong,LI Xinwei,et al.Study on the advanced treatment of secondary treated effluent by ozone oxidation[J].China Environmental Science,2014,34(5):1159-1165.
[8] MENG Hailing.Highly e cient degradation of phenol wastewater by microwave induced H2O2-CuOx/GAC catalytic oxidation process[J].Separation and Purification Technology,2018,193:49-57.
cient degradation of phenol wastewater by microwave induced H2O2-CuOx/GAC catalytic oxidation process[J].Separation and Purification Technology,2018,193:49-57.
[9] CAO Ranran.Ammonium-treated Birnessite-type MnO2 to increase oxygen vacancies and surface acidity for stably decomposing ozone in humid condition[J].Applied Surface Science,2019,495:143607-13.
[10] CHENG Li,WANG Jinguo,ZHANG Chi.boosting acetone oxida-tion e ciency over MnO2 nanorods by tailoring crystal phases[J].New Journal.Chemical,2019,(43):19126-19136.
ciency over MnO2 nanorods by tailoring crystal phases[J].New Journal.Chemical,2019,(43):19126-19136.
[11] 杨 静,王建兵,王亚华,等.高级氧化工艺处理煤化工浓盐水[J].环境工程学报,2015,9(8):3680-3686.
YANG Jing,WANG Jianbing,WANG Yahua,et al.Treatment of coal chemical concentrated brine by advanced oxidation process [J].Chinese Journal of Environmental Engineering,2015,9(8):3680-3686
[12] CAO Fang.Facile synthesis of alkaline-earth metal manganites for the ef cientdegradation of phenolic compounds via catalytic ozonation and evaluation of the reaction mechanism[J].Journal of Colloid and Interface Science,2019,551:164-176.
cientdegradation of phenolic compounds via catalytic ozonation and evaluation of the reaction mechanism[J].Journal of Colloid and Interface Science,2019,551:164-176.
[13] YANG R,REN C,TENG X,et al.,Study of the surface oxygen vacancies evolvement on the single and bi-components manganese oxide precursors and their catalytic performance[J].Catalysts Letter,2017,147:727-37.
[14] AMR Hussein Mady,MARJORIE Lara Baynosa,DIRK Tuma,et al.Het-erogeneous activation of peroxymono sulfate by a novel magnetic 3D γ-MnO2@ZnFe2O4/rGO nanohybrid as a rrobust catalyst for phenol degradation[J].Applied Catalyst B,2019,24(4):946-956.
[15] LIU Yang,ZHOU Hao,CAO Ranran.Facile and green synthetic strategy of birnessite-type MnO2 with high e ciency for air borne benzene removal at low temperatures[J],Applied Catalyat B,2019,24(5):569-582.
ciency for air borne benzene removal at low temperatures[J],Applied Catalyat B,2019,24(5):569-582.
[16] MO Shengpeng,ZHANG Qi,LI Jiaqi,et al.,Highly e cient mesoporous MnO2 catalysts for the total toluene oxidation:Oxygen-Vacancy defect engineering and involved intermediates using in situ DRIFTS[J].Applied Catalyst,2020,26(4):118-124.
cient mesoporous MnO2 catalysts for the total toluene oxidation:Oxygen-Vacancy defect engineering and involved intermediates using in situ DRIFTS[J].Applied Catalyst,2020,26(4):118-124.
[17] WU Zongwei,ZHANG Guoquan,ZHANG Ruoyu.Insights into mechanism of catalytic ozonation over practicable mesoporous mn-CeOx/γ-Al2O3[J].Catalysts,2018,(57):1943-1953.
[18] XIA Liquan,CHEN Guifeng,LI Wenbo.Influence of oxygen vacancy in mangan-based catalyst on phenol removal via catalytic ozonation[J].J Energy Envir &Chem Eng,2020,5(4):48-56.
[19] 马军祥,罗从光,付鹏兵,等.Mn-Ce臭氧催化氧化催化剂的制备及其对煤化工废水的处理[J].化工新型材料,2018,46(7):277-279.
MA Junxiang,LUO Congguang,FU Pengbing,et al.Preparation of Mn-Ce ozonation catalyst for the treatment of coal chemical wastewater [J],New Chemical Materials,2018,46(7):277-279.
[20] MOULAVI M H,KALE B B,BANKARD D,et al.Green synthetic methodology:an evaluative study for impact of surface basicity of MnO2 doped MgO nanocomposites in Wittig reaction[J].Journal of Solid State Chemical,2019,269:167-174.