

二氧化碳(CO2)被认为是导致全球气候变化的主要因素,因此受到越来越多的关注[1]。碳捕集和储存(CCS)技术被认为是降低大气中CO2含量最有希望的方法。CO2捕集技术有很多种:液氨吸收、膜分离、吸附等。液氨吸收技术较为成熟,已在许多电厂得到商业应用。然而,它存在许多缺点:能耗高、设备腐蚀、有毒和胺损失等[2]。因此,由于多孔材料具有较高的CO2吸附能力、更高的效率和较低的再生能量需求,因此其CO2吸附进入了研究人员的视野[3-4]。最理想的CO2吸附剂必须具有高吸附容量、稳定性和低成本[5-6]。然而,要生产传统的CO2吸附剂,如沸石、石墨烯和金属氧化物,通常需要进行繁琐的步骤,如高温煅烧或重复洗涤[7-8],这限制了传统CO2吸附剂的大规模生产和应用。
金属-有机骨架(MOF)由金属离子(或团簇)和有机连接物组成,具有高比表面积、孔径可维持性、大孔体积等优异性能,在催化、药物释放、分离,特别是气体储存等方面具有很高的应用潜力[9-12]。富马酸铝MOF由铝离子和富马酸自由基构成。其孔径为0.6 nm×0.45 nm[13]。富马酸铝MOF的热稳定性和湿稳定性在众多MOF中最为突出。因此,它在气体吸附和分离[14-15]、污染物去除[16-17]、电池[18]和热泵应用[19-20]方面具有巨大潜力。富马酸铝MOF的传统合成方法是水热合成:将铝盐、富马酸、氢氧化钠或尿素溶解在热水中一定时间,生成富马酸铝MOF[13,15,21]。这种方法的缺点是残留的有机连接物难以去除,热反应的解决效率不高。以富马酸二钠作为连接源在室温条件下快速合成类似富马酸铝MOF的微球吸附剂(mAlFu),并通过不同手段,包括微观形貌分析 (SEM),晶相分析 (XRD),官能团分析 (FT-IR)对该种材料进行表征,同时进行吸附实验获得mAlFu吸附剂的吸附等温线,循环再生性能。同时获得了mAlFu的晶格结构,对mAlFu吸附剂进行了CO2吸附模拟,获得了吸附热。最后对CO2选择性进行了研究,获得了mAlFu在模拟烟气组分下的CO2选择性。
九水合硝酸铝(Al(NO3)3·9H2O)来自成都市科龙化工试剂厂,纯度为99%。富马酸二钠(C4H2Na2O4)来自成都麦卡希试剂。聚乙烯亚胺(PEI-1 800)来自阿达玛斯试剂厂,纯度为99%。
AlFu吸附剂合成方法为,将三滴的聚乙烯亚胺(PEI)(ADAMAS,M.W.=1 800)和12.4 mmol富马酸二钠以及6.2 mmol六水合硝酸铝分别添加到31 mL去离子水中。完全溶解后,将这2种溶液混合并搅拌10 min。获得产物经过洗涤,干燥获得白色固体。
通过Empryean X射线衍射仪上获得了样品的XRD图谱。通过SEM(Hitachi,S-4800型)测定样品的形貌和微观结构。在Nicolet iS5上进行了傅里叶变换红外光谱分析。微孔全分析在ASAP2460(物理吸附仪)上测试,以确定样品的表面积和孔径。在STA409PC/PG Luxx(德国NETEZ)上获得材料热稳定性。
图1为合成的mAlFu的SEM图像。可以清楚地观察到吸附剂已达到微球状结构,一些颗粒出现团聚,大多数mAlFu的粒径分布在200~400 nm。

图1 mAlFu吸附剂的微观形貌
Fig.1 SEM morphology of mAlFu sorbents
图2a显示了合成的mAlFu的XRD图谱。样品在11°、15°、22°处呈现特征峰,与模拟的XRD图谱吻合良好,这意味着使用富马酸二钠作为连接源成功合成了富马酸铝MOF。图2b显示了mAlFu的FT-IR光谱图。3 650~3 700 cm-1处清晰观察到的峰是—OH带,1 616 cm-1和1 427 cm-1处的峰是羧基的拉伸,这表明化合物中存在富马酸盐,结果与AlFu在文献[16]的研究结果一致[16]。

图2 mAlFu吸附剂的结构表征
Fig.2 Structural characterization of mAlFu sorbents
图3显示了mAlFu的热重分析(TG)和差热重分析(DTG)曲线。发现曲线中有3个失重步骤。第1次试验在30~100 ℃开始,这可归因于样品吸收水的损失。第2个轻微的失重步骤开始于250 ℃左右,这表明样品在结晶水中的失重。最后的失重步骤在约400 ℃时开始,这表明mAlFu结构分解。结果与其他一些试验数据一致[13,16]。
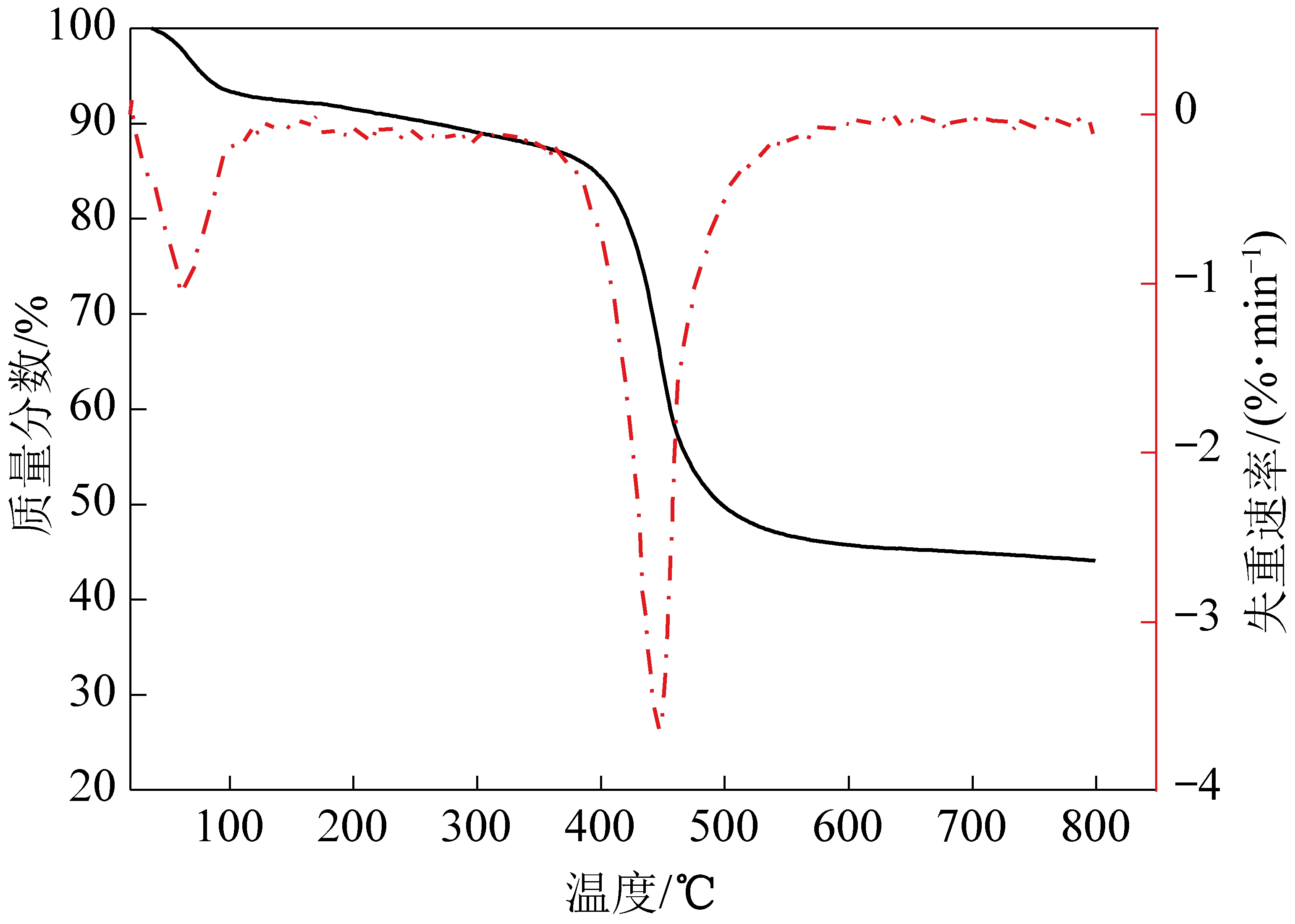
图3 mAlFu吸附剂的TG/DTG曲线
Fig.3 TG/DTG curves of mAlFu sorbents
图4a给出了mAlFu的氮气吸附/解吸等温线,这是典型的I等温线。这表明结构中存在微孔,并且滞后环意味着中孔和大孔也包含在结构中,这可能是由于颗粒团聚或微球之间的空隙造成的。mAlFu的总孔体积为0.4 cm3/g,BET表面积为833.4 m2/g,远大于文献[14,17,21]中报道的溶剂热合成值,这是因为合成方法改变后,PEI能够增加mAlFu颗粒孔的拓展延伸,同时颗粒内部有机物杂质更容易被清洗去除,增加了颗粒比表面积。mAlFu的孔径分布曲线如图4b所示,其使用DFT模型计算。它显示了2个域的孔径,分别为0.5 nm和1.1 nm,这与文献[22-23]中的研究结果一致。
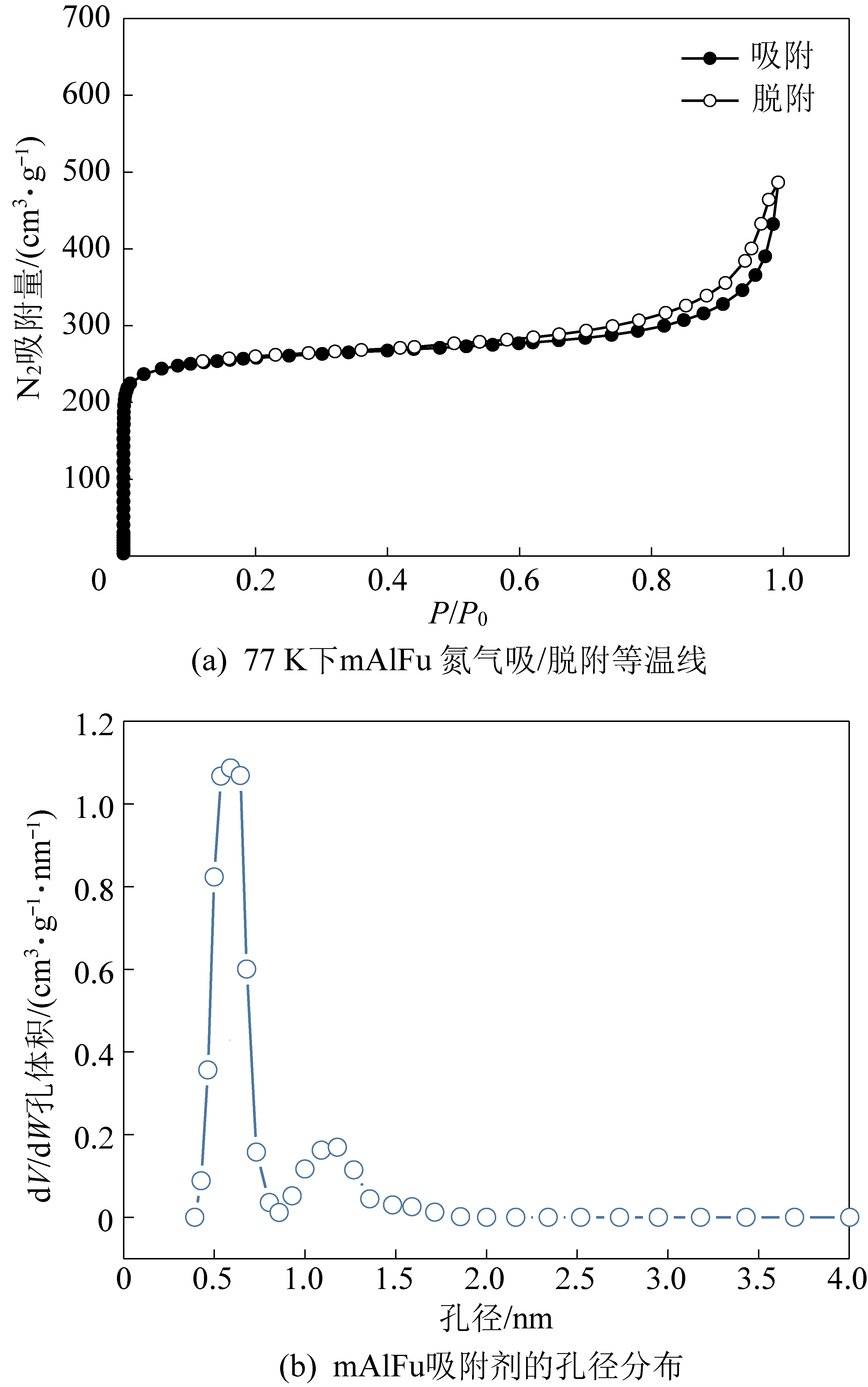
图4 mAlFu吸附剂孔径分析
Fig.4 Pore size analysis of mAlFu sorbents
ASAP2420(物理吸附仪)上获得303 K下的CO2吸附等温线。首先在423 K真空下脱气6 h进行吸附剂预处理。随后待到温度达到至303 K,进行CO2吸附试验。为了研究mAlFu的循环再生性能,在STA409PC/PG Luxx(德国NETEZ)上进行了多次吸附/脱附试验。每次实验前,在423 K高纯氮气气氛下对样品进行脱气预处理,随后待到温度降至吸附温度时,切换气体组分为CO2,通过记录样品的质量变化获得吸附剂CO2吸附量。吸附饱和后,在423 K,N2组分下再生吸附剂,随后进行循环实验。循环5次后停止试验。
2.2.1 吸附模型
AlFu的晶体结构(CCDC:1751975)在剑桥晶格数据库中获得,如图5a所示。随后采用密度泛函理论(DFT)对晶格进行结构优化,采用的软件为Materials Studio,模块是CASTEP,详细模块设置参数如下:函数选择PW91与广义梯度近似泛函(GGA),适用OBS的DFT-D校正方法,然后对晶格进行结构优化,获得能量最低的结构。
固体吸附模拟过程中对固体单元的电荷计算是评判模拟结果正确与否的一个重要因素,因此对mAlFu电荷计算,步骤如下:富马酸铝是一个周期性的结构,因此在计算电荷时,只需要对最小的一个配体结构进行计算,结构选取的最小单元为一个富马酸配体及与4个无机单元(AlO5),其中不饱和的键进行加氢饱和,最小结构单元结构(线型)如图5b所示。为了便于区分,采用球-棍模型显示特征原子,并对其进行相应编号。电荷计算采用Gaussian09软件,设置参数如下:计算过程采用密度泛函理论(DFT),基组为6-31G(图5d)。表1为计算获得的mAlFu各类原子电荷量。

图5 吸附模拟采用的模型
Fig.5 Models used in adsorption simulation
表1 AlFu吸附剂中各原子电荷量
Table 1 Charges of atoms in AlFu sorbents

原子AlH1H2O1O2C1C2电荷1.890.470.16-1.42-0.780.97-0.24
吸附质分子模型是参考文献报道,如图5所示,CO2采用刚性三原子模型,其中O原子电荷为-0.35e,C原子为0.7e,N2采用刚性双原子模型,N原子电荷为0[24-25]。
2.2.2 吸附计算原理
巨正则蒙特卡罗方法(GCMC)是模拟吸附剂吸附的气体的常用方法,本文mAlFu的CO2吸附模拟是在此基础上进行。模拟吸附采用的软件为Material Studio,模块为Sorption。在整个吸附过程中,吸附质与吸附剂都处理为刚性结构,根据Metropolis算法通过对吸附质分子进行随机添加,删除,移动,旋转等操作,计算体系能量来判断吸附质吸附位置的准确性。GCMC法对吸附质进行气体吸附模拟时,吸附质与吸附剂之间包含2种相互作用力,即范德华非键作用的Lennard-Jones (LJ)相互作用势能与静电势Coulombic势能,通过两者求和法获得吸附质与吸附剂之间作用力。其计算式如式(1)所示:
(1)
式中:rij为i原子与j原子之间的距离;σij为LJ势为0时,i和j原子间的距离,εij为势阱深度(是原子i和原子j间距离r= 2^(1/6)σ时的LJ势,两个参数皆为LJ势能参数;qi和qj分别为i原子与j原子所带的电荷量;ε0为真空介电常数,其值为8.854 2×10-12 C2/(N·m-2)。
在进行吸附模拟时,Sorption模块参数设置如下:采用Atom-Based计算分子间作用力。截断半径为1.15 nm[26];静电作用力采用Ewald求和法。吸附过程中mAlFu吸附模型为4×2×2超晶胞,势能参数是描述吸附剂和吸附质之间的力的重要参数,是评判吸附结果正确性的另外一个重要因素。模拟选择的原子间LJ势能参数采用Lorentz-Berthelot (LB) 混合规则计算,气体分子LJ势能参数主要参考DUNDAR等[24]的设置方法,力场参数见表2。这种设置方法进行MIL-53金属有机骨架吸附CO2模拟计算所得结果和实验结果相符较好。模拟计算的发展步长为107步,平衡步长为107步。在每一次吸附计算时,软件初始配置是一个不包含吸附质的吸附剂原始晶胞,通过添加吸附质组分比例来模拟吸附质。基于Metropolis算法根据能量变化来接受或拒绝吸附的CO2分子,确定设置模拟条件参数(温度,压力,吸附质)后,可以获得吸附剂在当前设置条件下的CO2吸附等温线。笔者通过设置压力范围0~150 kPa,温度,设置CO2/N2的比例获得一系列吸附等温线。吸附热和气体选择性都是基于吸附等温线推导或演化获得。
表2 气体分子及超晶胞中各原子的LJ势能参数
Table 2 L-J potential parameters of atoms in gas and supercells
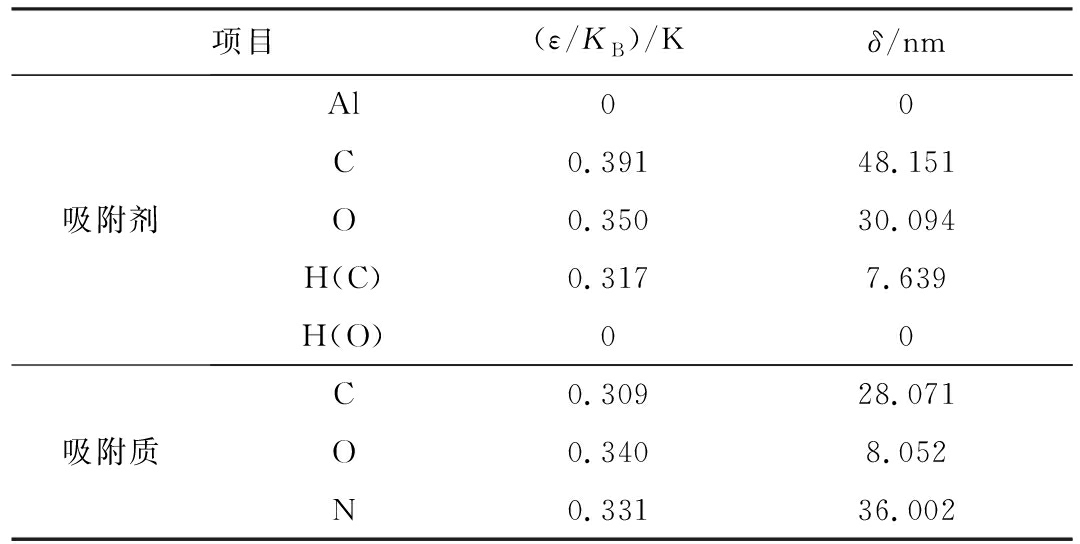
项目(ε/KB)/Kδ/nm吸附剂Al00C0.39148.151O0.35030.094H(C)0.3177.639H(O)00吸附质C0.30928.071O0.3408.052N0.33136.002
注:δ、ε均为势能参数;KB为修正系数;ε/KB去修正后的势能参数;H(C)、H(O)分别为吸附剂结构中与O原子连接的H原子,与C原子连接的H原子。
2.3.1 单组分下mAlFu吸附剂CO2吸附特性
图6显示了合成的mAlFu在303 K下的CO2吸附等温线,很明显,mAlFu的CO2吸附量随着压力的增加而增加,并且mAlFu在303 K和100 kPa下CO2吸附量为2.21 mmol/g。该值略大于先前的报告[14],尽管简单合成的mAlFu的比表面积略小于报告的富马酸铝MOF,但通过延长mAlFu的活化时间,可以暴露更多的CO2吸附位点,从而提高吸附容量。与其他报道的CO2吸附剂相比,mAlFu在相同条件下表现出更高的CO2吸附能力[27-28]。
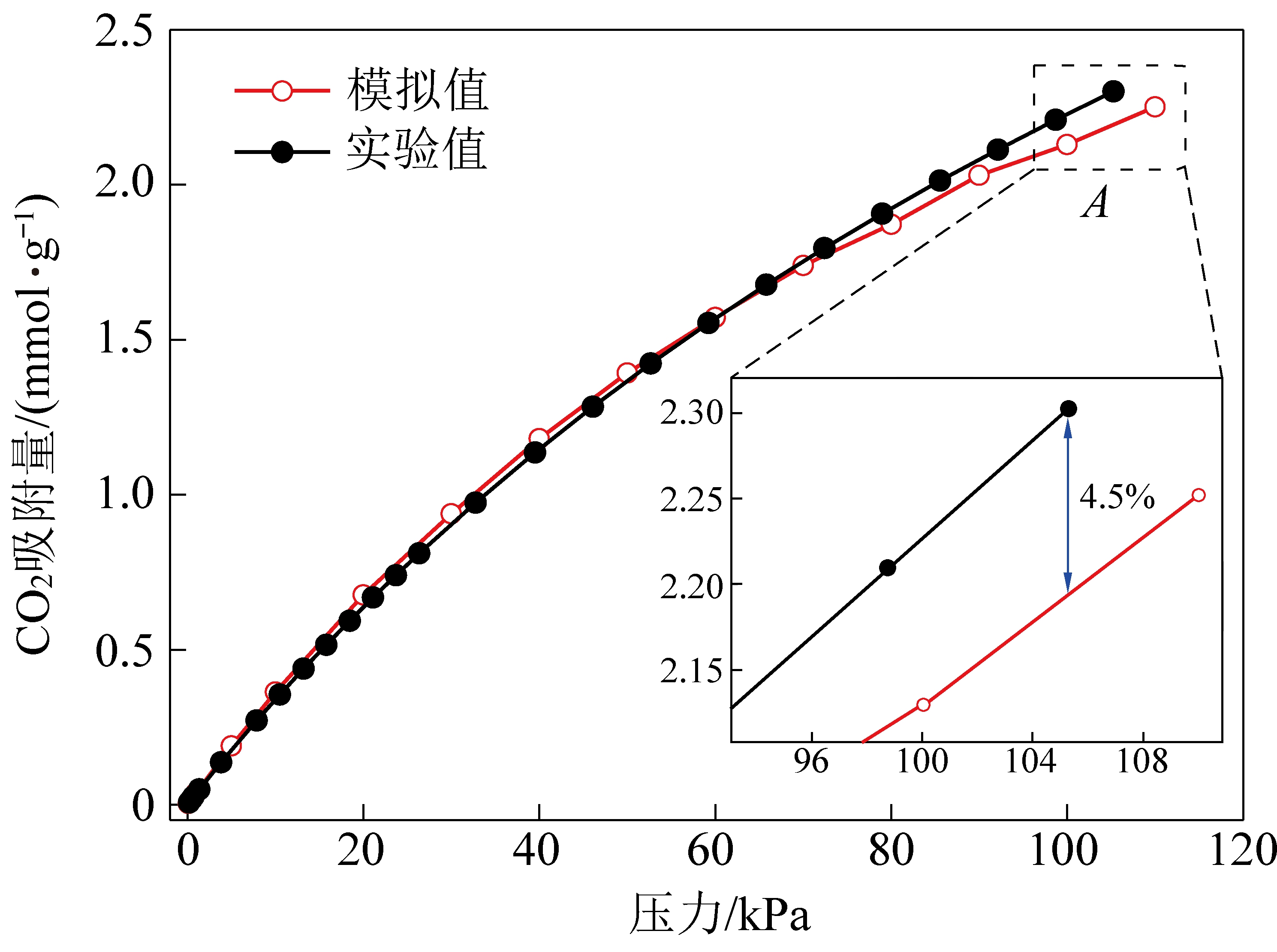
图6 实验及模拟所得mAlFu在303 K下CO2 吸附等温线
Fig.6 CO2 adsorption isotherms of mAlFu sorbents at 30 ℃ obtained by experiment and simulation
mAlFu吸附模拟通过对比试验值与模拟值进行验证,模拟结果显示通过GCMC法吸附模拟获得的吸附等温线与试验值趋势保持一致,且具有很小的误差,在105 kPa时误差仅为4.5%。通过模拟计算得到mAlFu在100 kPa、30 ℃下的CO2吸附量为2.13 mmol/g,和文献[13]报道的试验结果2.1 mmol/g相差1.41%,和文献[26]报道的模拟结果1.96 mmol/g相差7%,均在可接受误差范围之内,这说明采用的mAlFu晶格参数优化方法,LJ势能参数选取、mAlFu晶格原子电荷量计算等方法适用于mAlFu吸附剂CO2吸附模拟,模拟结果正确可靠,说明采用的模拟方法可以对吸附剂在很多条件下的吸附预测,节省实验带来的成本,同时本文获得了不同压力下的AlFu吸附剂的CO2吸附热,如图7所示。
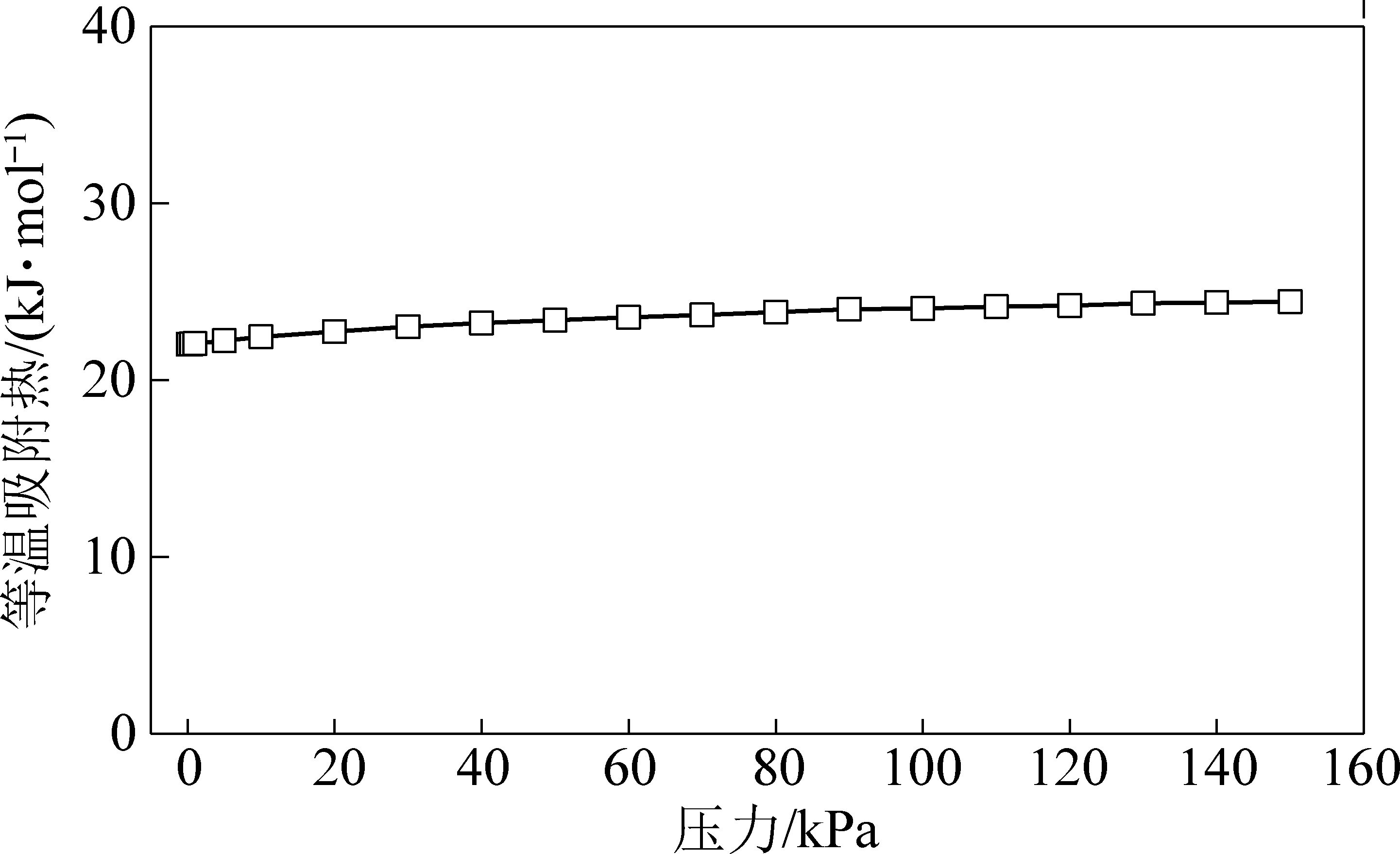
图7 mAlFu吸附剂的吸附热
Fig.7 Adsorption heat of mAlFu adsorbent
2.3.2 CO2/N2双组分下mAlFu的CO2吸附选择性
mAlFu在CO2吸附情况下的吸附量表征的是纯CO2吸附能力,然而在复杂情况下,特别是在电厂烟道气中,烟气成分较为复杂,脱硫脱硝后,烟气成为一般为CO2/N2混合气,CO2体积分数在15%~20%,在混合气体中通常存在竞争吸附。因此研究在混合气中mAlFu的CO2吸附能力尤其重要。通过对mAlFu吸附剂在CO2/N2双组分气体条件下的CO2吸附模拟,计算了其CO2的吸附选择性。在双组分条件下CO2吸附选择性计算方法如式(2)所示:
(2)
式中:S为吸附剂的分离比;xCO2和xN2为代表吸附前的混合气体中CO2和N2所占的摩尔比;yCO2和yN2分别为吸附剂吸附的CO2和N2物质的量。
采用CO2与N2预混来模拟电厂烟道气,CO2与N2体积比为1∶4。通过吸附模拟获得了mAlFu吸附剂在0下的CO2和N2的吸附等温线,通过式(2)的计算方法获得在烟道气中的CO2选择性,结果如图8所示。低压下压力直接影响吸附剂气体吸附能力,因此可以看出,在混合烟道气中,mAlFu对CO2和N2均有吸附能力,且CO2吸附量和N2吸附量均随着压力的增加而增加,CO2的吸附量明显高于N2的吸附量,在150 kPa下mAlFu的CO2吸附量为1.168 mmol/g,N2的吸附量为0.328 mmol/g,计算获得CO2选择性为14.438。

图8 mAlFu对CO2的选择吸附性能
Fig.8 CO2 selective adsorption performance of mAlFu
2.3.3 mAlFu吸附剂的循环再生性能
图9显示了mAlFu的再生性能。CO2 吸附容量为1.6 mmol/g,根据图9中记录为蓝线的mAlFu质量变化计算得出。计算的吸附容量小于等温线,因为氮气被用作净化气体再生mAlFu,氮气占据了mAlFu的一些吸附位点,导致CO2吸附量减少。很明显,在5次吸附/解吸循环后,吸附容量没有下降,这是因为本文合成的mAlFu吸附剂结构稳定性好,且在循环过程中CO2吸附位点仍能保持CO2活性,这意味着mAlFu具有捕集CO2的潜力。

图9 30 ℃下AlFu吸附剂循环再生性能
Fig.9 CO2 cyclic performance of AlFu adsorbent at 30 ℃
1)在室温条件下快速合成了mAlFu微球吸附剂,其热分解温度为400 ℃,在303 K和100 kPa下可以吸收2.21 mmol/g CO2,较高的热稳定性说明mAlFu吸附剂能够应用于电厂烟气的CO2捕集。
2)优化mAlFu晶胞,计算其最小组成单元的电荷量,进行基于GCMC法的CO2吸附模拟,吸附实验与计算值得对比表明,选取的LJ势能模拟参数可用于mAlFu吸附剂的CO2吸附模拟。
3)通过模拟计算获得CO2/N2混合气体下的mAlFu的CO2分离比为14。
4)循环再生试验说明AlFu吸附剂经过多次再生后能够保持完好的CO2吸附再生性能。
[1] PROGRAMME U. The Emissions Gap Report 2017:A UN Environment Synthesis Report[R],2017.
[2] LA O,BELLO A,IDEM R,et al. The Role of methyl diethanolam-ine (MDEA) in preventing the Oxidative Degradation of CO2 loaded and Concentrated Aqueous Monoethanolamine (MEA)-MDEA blends during CO2 absorption from flue gases[J]. Industrial & Engineering Chemistry Research,2005,44(6):1874-1896.
[3] DUTCHER B,FAN M.,RUSSELL A G. Amine-based CO2 ca-pture technology development from the beginning of 2013-a review[J]. Acs Appl Mater Interfaces,2015,7(4):2137-2148.
[4] SABOUNI R,KAZEMIAN H,ROHANI S. Carbon dioxide captu-ring technologies:a review focusing on metal organic framework materials (MOFs)[J]. Environmental Science & Pollution Research,2014,21(8):5427-5449.
[5] SONGOLZADEH M,SOLEIMANI M,RAVANCHI M T,et al. Carbon dioxide separation from flue gases:a technological review emphasizing reduction in greenhouse gas emissions[J]. Scientific World Journal,2014,2014(1):828131.
[6] SEVILLA M,FUERTES A B. CO2 adsorption by activated tem-plated carbons[J]. Journal of Colloid & Interface Science,2012,366(1):147-154.
[7] AHMED S,RAMLI A,YUSUP S,et al. Development of polyethylenimine-functionalized mesoporous Si-MCM-41 for CO2 adsorption[J]. Fuel Processing Technology,2017,167:622-630.
[8] SU X,BROMBERG L,MARTIS V,et al. Post-Synthetic functionalization of Mg-MOF-74 with Tetraethylenepentamine:structural characterization and enhanced CO2 adsorption[J]. Acs Appl Mater Interfaces,2017,9(12):11299-11306.
[9] CHEN L Y,GAO Z Q,LI Y W,et al. Immobilization of Pd(II) on MOFs as a highly active heterogeneous catalyst for Suzuki-Miyaura and Ullmann-type coupling reactions[J]. Catalysis Today,2015,245(Supplement C):122-128.
[10] JIANG K,ZHANG L,HU Q,et al. Pressure controlled drug rel-ease in a Zr-cluster-based MOF[J]. Journal of Materials Chemistry B,2016;4(39):6398-6401.
[11] LEE D J,LI Q M,KIM H,et al. Preparation of Ni-MOF-74 membrane for CO2 separation by layer-by-layer seeding technique[J]. Microporous and Mesoporous Materials,2012,163:169-177.
[12] LIANG L F,LIU C P,JIANG F L,et al. Carbon dioxide capture and conversion by an acid-base resistant metal-organic framework[J]. Nature Communications,2017,8(1):1233.
[13] ALVAREZ E,GUILLOU N,MARTINEAU C,BUEKWN B,et al. The Structure of the Aluminum Fumarate Metal-Organic Framework A520[J]. Angewandte Chemie,2015,54(12):3664-3668.
[14] COELHO J A.,RIBEIRO A M,FERREIRA ALEXANDRE F P,et al. Stability of an Al-Fumarate MOF and Its Potential for CO2 Capture from Wet Stream[J]. Industrial & Engineering Chemistry Research,2016,55(7):2134-2143.
[15] TEO H W B,CHAKRABORTY A,KITAGAWA Y J,KAYAL S,et al. Experimental study of isotherms and kinetics for adsorption of water on Aluminium Fumarate[J]. International Journal of Heat and Mass Transfer,2017,114(Supplement C):621-627.
[16] ZHOU L,ZHANG X H,CHEN Y L,et al. Facile synthesis of Al-fumarate metal-organic framework nano-flakes and their highly selective adsorption of volatile organic compounds[J]. Materials Letters,2017,197:224-227.
[17] KARMAKAR S,BHATTACHARJEE S,DE S,et al. Experimental and modeling of fluoride removal using aluminum fumarate (AlFu) metal organic framework incorporated cellulose acetate phthalate mixed matrix membrane[J]. Journal of Environmental Chemical Engineering,2017,5(6):6087-6097.
[18] WANG Y,QU Q J,LIU G,et al. Aluminum fumarate-based metal organic frameworks with tremella-like structure as ultrafast and stable anode for lithium-ion batteries[J]. Nano Energy,2017,39:200-210.
[19] YOUSSEF P,MAHMOUD S,Al-DADAH R,et al. Numerical Investigation of Aluminum Fumarate MOF adsorbent material for adsorption desalination/cooling application[J]. Energy Procedia,2017,142:1693-1698.
[20] ELSAYED E,Al-DADAH R,MAHMOUD S,et al. Aluminium fumarate and CPO-27(Ni) MOFs:Characterization and thermodynamic analysis for adsorption heat pump applications[J]. Applied Thermal Engineering,2016,99:802-812.
[21] JUNG K W,CHOI B H,DAO C M,et al. Aluminum carboxylate-based metal organic frameworks for effective adsorption of anionic azo dyes from aqueous media[J]. Journal of Industrial and Engineering Chemistry,2018,59:149-159.
[22] BOZBIYIK B,LANNOEYE J,DE VOS D E,et al. Shape selective properties of the Al-fumarate metal-organic framework in the adsorption and separation of n-alkanes,iso-alkanes,cyclo-alkanes and aromatic hydrocarbons[J]. Physical Chemistry Chemical Physics,2016,18(4):3294-3301.
[23] KAYAL S,CHAKRABORTY A,TEO HOW W B,et al. Green synthesis and characterization of aluminium fumarate metal-organic framework for heat transformation applications[J]. Materials Letters,2018,221:165-167.
[24] DUNDAR E,CHANUT N,FORMALIK F,et al. Modeling of adsorption of CO2 in the deformed pores of MIL-53(Al)[J]. Journal of Molecular Modeling,2017,23(4):101.
[25] YU J M,BALBUENA P B,et al. How impurities affect co2 cap-ture in metal-organic frameworks modified with different functional groups[J]. ACS Sustainable Chemistry & Engineering,2015,3(1):117-124.
[26] COELHO J A.,LIMAO ADRIANO E O,RODRIGUES A E,et al. Computer simulation of adsorption and sitting of CO2,N2,CH4 and water on a new Al(OH)-fumarate MOF[J]. Adsorption,2017,23(2):423-431.
[27] REGUFE M J,TAMAJON J,RIBEIRO A M.,et al. Syngas Purification by porous amino-functionalized titanium terephthalate MIL-125[J]. Energy & Fuels,2015,29(7):4654-4664.
[28] SAHA D,BAO Z B,JIA F,et al. Adsorption of CO2,CH4,N2O,and N2 on MOF-5,MOF-177,and Zeolite 5A[J]. Environmental Science & Technology,2010,44(5):1820-1826.